Introducción
La fisiopatología de la enfermedad por reflujo gastroesofágico (ERGE) es compleja y multifactorial. A diferencia del concepto tradicional que atribuía la enfermedad a una hipersecreción ácida, en la actualidad se reconoce que el desarrollo de ERGE implica un desequilibrio dinámico entre factores agresores –como la acidez del contenido gástrico, la frecuencia de los eventos de reflujo y la sensibilidad esofágica– y mecanismos de defensa –como la integridad de la barrera antirreflujo, el aclaramiento ácido y la resistencia de la mucosa esofágica1,2.
Diversos elementos anatómicos y funcionales participan en la génesis del reflujo patológico. Entre ellos, las relajaciones transitorias del esfínter esofágico inferior (EEI) constituyen el mecanismo más común en individuos sin alteraciones anatómicas evidentes. Por otro lado, la presencia de una hernia hiatal representa una alteración anatómica que debilita la eficacia de la barrera antirreflujo y facilita la migración del contenido gástrico hacia el esófago3–6.
Además de estos componentes estructurales y funcionales, se ha reconocido el papel fundamental de la hipersensibilidad esofágica y de la alteración del eje intestino-cerebro en la generación y la percepción de los síntomas. Factores psicológicos como la ansiedad, la depresión y la hipervigilancia sensorial pueden amplificar la respuesta sintomática a estímulos menores, e incluso generar síntomas en ausencia de exposición ácida anormal7,8.
En años recientes se ha propuesto un nuevo actor fisiopatológico: la microbiota esofágica. Los cambios cualitativos en la población microbiana del esófago podrían influir en la inflamación mucosa, la permeabilidad epitelial y la progresión hacia lesiones premalignas. Aunque su papel exacto aún no está completamente elucidado, constituye una línea emergente de investigación con importantes implicaciones clínicas y terapéuticas9.
El objetivo de este artículo es revisar de manera estructurada y crítica los principales mecanismos fisiopatológicos implicados en la ERGE, integrando evidencia reciente sobre aspectos anatómicos, neurofuncionales y microbianos. Una comprensión integral de estos factores es esencial para optimizar el abordaje diagnóstico y terapéutico de los pacientes con esta enfermedad.
Método
Este artículo constituye una revisión narrativa basada en la literatura científica publicada sobre los mecanismos fisiopatológicos de la ERGE. Se realizó una búsqueda estructurada en la base de datos PubMed utilizando los descriptores MeSH “Gastroesophageal Reflux”, “Lower Esophageal Sphincter”, “Hiatal Hernia”, “Esophageal Motility Disorders”, “Esophageal Sensitivity”, “Gut-Brain Axis” y “Esophageal Microbiome”. Se seleccionaron artículos publicados entre 2015 y 2025, en inglés y español, priorizando revisiones sistemáticas, estudios fisiológicos, trabajos mecanísticos en humanos y ensayos clínicos relevantes.
Además, se integró literatura más antigua, publicada antes de 2015, que fue considerada de alto impacto histórico y conceptual en la descripción original de los mecanismos fisiopatológicos de la ERGE; se incluyeron trabajos fundacionales sobre las relajaciones transitorias del EEI, la función del diafragma crural y las primeras caracterizaciones histopatológicas de la mucosa esofágica en presencia de reflujo ácido.
La revisión se organizó en torno a cinco ejes fisiopatológicos: 1) relajaciones transitorias del EEI, 2) disfunción de la barrera antirreflujo (hernia hiatal), 3) alteraciones en los mecanismos de defensa esofágica, 4) implicaciones del eje esófago-cerebro, y 5) papel emergente de la microbiota esofágica.
Dado que este trabajo no involucró sujetos humanos ni animales, ni manejo de información sensible, no se requirió la aprobación por parte de un comité de ética ni la obtención del consentimiento informado.
El objetivo fue realizar una revisión crítica, estructurada y actualizada de la fisiopatología de la ERGE, integrando los avances recientes con conceptos clásicos, que sirva de base para una mejor comprensión clínica y el desarrollo de intervenciones terapéuticas racionales.
Resultados
Mecanismos fisiopatológicos clave de la ERGE
La fisiopatología de la ERGE se basa en un desequilibrio entre factores agresores (frecuencia y características del reflujo) y factores defensivos (barrera antirreflujo e integridad de la mucosa). Tres pilares fisiopatológicos han sido implicados en el desarrollo y la progresión de la enfermedad: las relajaciones transitorias del EEI, las alteraciones anatómicas de la barrera esofagogástrica (especialmente la hernia hiatal) y las disfunciones en los mecanismos de defensa esofágica (Table 1).
Tabla 1. Comparación de los mecanismos de reflujo
| Mecanismo | Descripción | Frecuencia en la ERGE | Factores asociados |
|---|---|---|---|
| Relajaciones transitorias del EEI | Relajaciones prolongadas (> 10 s), no asociadas a deglución, con inhibición del diafragma crural | 50-90% de los episodios | Distensión gástrica, ausencia de hernia hiatal |
| Relajaciones por deglución | Relajaciones breves (5-10 s) asociadas a peristalsis | 5-10% de los episodios | Hernia hiatal, peristalsis ineficaz |
| EEI hipotenso | Presión basal < 5-10 mmHg, permite el reflujo libre o inducido por esfuerzo | Poco común, hasta 25% en esofagitis grave | Esclerodermia, miotomía, hernia hiatal |
|
EEI: esfínter esofágico inferior; ERGE: enfermedad por reflujo gastroesofágico. |
|||
Barrera antirreflujo
La defensa inicial del esófago contra el daño por ácido está conformada por la barrera antirreflujo. Esta barrera se caracteriza por ser una región anatómica compleja que engloba el EEI intrínseco, la crura del diafragma, la posición intraabdominal del EEI, los ligamentos frenoesofágicos y el ángulo de His.
El EEI abarca los 3-4 cm distales del esófago y en estado basal se encuentra tónicamente contraído10. Constituye el principal componente de la barrera antirreflujo, con la capacidad de prevenir el reflujo incluso cuando se encuentra por completo desplazado de la crura diafragmática debido a una hernia hiatal11. La porción proximal del EEI se localiza normalmente entre 1.5 y 2 cm por encima de la unión escamocolumnar, mientras que el segmento distal, de aproximadamente 2 cm de longitud, se sitúa dentro de la cavidad abdominal. Los estudios anatómicos atribuyen a esta parte de la barrera antirreflujo una función similar a la de un pliegue, relacionada con las fibras musculares en honda y en ojal del cardias gástrico. Esta ubicación permite mantener la competencia gastroesofágica durante los aumentos de la presión intraabdominal.
La presión basal del EEI varía entre 10 y 30 mmHg, con una capacidad de reserva considerable, dado que solo se requiere una presión de entre 5 y 10 mmHg para evitar el reflujo gastroesofágico4. Esta zona de alta presión se mantiene gracias al tono intrínseco del músculo del EEI y a la actividad de neuronas colinérgicas excitatorias. La presión basal del EEI presenta variaciones diurnas significativas: es más baja después de las comidas y alcanza su punto más alto durante la noche; además, se incrementa marcadamente durante la fase III del complejo motor migratorio. También está modulada por péptidos y hormonas circulantes, alimentos (especialmente los ricos en grasa) y diversos fármacos.
El EEI se encuentra ubicado dentro del hiato diafragmático, formado por el pilar derecho del diafragma, y está anclado por los ligamentos frenoesofágicos, los cuales se insertan a nivel de la unión escamocolumnar. El hiato es un canal con forma de gota, de aproximadamente 2 cm en su eje mayor. Desde el punto de vista del desarrollo embrionario, el pilar diafragmático deriva del mesenterio dorsal del esófago y presenta una inervación distinta de la del diafragma costal. Esta estructura se inhibe ante la distensión esofágica, durante el vómito y durante las relajaciones transitorias del EEI, pero no durante la deglución. El diafragma crural proporciona una compresión extrínseca al EEI intrínseco, contribuyendo a la presión en reposo durante la inspiración y aumentando la presión del EEI durante episodios de presión abdominal elevada, como ocurre al toser, estornudar o agacharse12. Las contracciones del pilar crural generan incrementos rítmicos de presión sobre el EEI, del orden de 5 a 10 mmHg. Durante las inspiraciones profundas o en episodios de esfuerzo abdominal intenso, estos aumentos pueden alcanzar valores de entre 50 y 150 mmHg13.
La entrada oblicua del esófago al estómago genera un ángulo agudo en la cara de la curvatura mayor de la unión esofagogástrica (UEG), conocido como ángulo de His. En estudios realizados en cadáveres se ha demostrado que este ángulo produce un efecto de válvula en forma de aleta; sin embargo, su contribución específica a la competencia de la UEG permanece poco clara14.
Mecanismos de reflujo
El reflujo suele producirse por cuatro mecanismos principales: relajaciones transitorias del esfínter esofágico inferior, presión baja del EEI, relajación del EEI asociada a la deglución y esfuerzo durante periodos de presión disminuida del EEI (Table 2).
Tabla 2. Factores protectores y agresores en la enfermedad por reflujo gastroesofágico
| Factores protectores | Factores agresores | Impacto en la ERGE |
|---|---|---|
| Barrera antirreflujo (EEI, diafragma crural, ángulo de His) | Relajaciones transitorias del EEI, hernia hiatal | Aumenta la exposición al reflujo |
| Aclaramiento ácido (peristalsis, saliva) | Motilidad inefectiva, hiposialia | Prolonga la exposición al ácido |
| Integridad de la mucosa | Dilatación de los espacios intercelulares, permeabilidad aumentada | Hipersensibilidad esofágica |
| Modulación del eje intestino-cerebro | Ansiedad, depresión, hipervigilancia | Amplifica la percepción de síntomas |
|
EEI: esfínter esofágico inferior; ERGE: enfermedad por reflujo gastroesofágico. |
||
- − Relajaciones transitorias del EEI
- Constituyen el mecanismo predominante de reflujo tanto en sujetos sanos como en pacientes con ERGE, particularmente en aquellos con presiones del EEI normales y sin hernia hiatal. Estas relajaciones son episodios espontáneos, prolongados (> 10 segundos), no relacionados con la deglución, que no se acompañan de peristalsis esofágica y se asocian a inhibición activa del diafragma crural. Su estímulo fisiológico principal es la distensión del estómago proximal –especialmente del fundus– por alimento o gas, lo que resulta coherente con su función fisiológica como mecanismo del eructo3,5,6,15.
- Esta distensión activa un arco reflejo vagovagal complejo, que inicia en mecanorreceptores de las terminaciones laminares intraganglionares de aferencias vagales, proyectándose al tallo cerebral a través del núcleo del tracto solitario, hacia el núcleo motor dorsal del vago. Desde ahí, las señales se transmiten a neuronas inhibitorias localizadas en el plexo mientérico del esófago distal. Este circuito produce una respuesta motora integrada que incluye relajación del EEI, contracción de la musculatura longitudinal con acortamiento del esófago, disminución de la obstrucción en la UEG, inhibición del diafragma crural y contracción del diafragma costal16.
- Los estudios con manometría de alta resolución e impedancia han demostrado que las relajaciones transitorias del EEI explican prácticamente la totalidad de los episodios de reflujo en sujetos sanos y entre el 50% y el 90% de los eventos en los pacientes con ERGE, dependiendo de la presencia de hernia hiatal y de la gravedad de la esofagitis asociada. En sujetos sanos, entre el 40% y el 60% de las relajaciones transitorias del EEI se acompañan de reflujo, mientras que en los pacientes con ERGE este porcentaje se eleva al 60-70%. Algunos factores que podrían influir en la aparición de reflujo durante una relajación transitoria del EEI son el esfuerzo abdominal, la presencia de hernia hiatal, el grado de acortamiento esofágico y la duración del episodio de relajación.
- Aunque fisiológicas en la mayoría de los casos, en la ERGE estas relajaciones se vuelven más frecuentes, prolongadas y con un grado de apertura del EEI mayor, lo que resulta en una mayor exposición del esófago al ácido gástrico, la bilis y la pepsina3,5,6,15.
- La inhibición farmacológica de las relajaciones transitorias del EEI ha sido ampliamente estudiada. Diversos compuestos –incluidos antagonistas del receptor CCK-A, fármacos anticolinérgicos, morfina, somatostatina, inhibidores del óxido nítrico, antagonistas del receptor 5-HT3 y agonistas del receptor GABAβ– han mostrado capacidad para reducir la frecuencia de estos eventos; sin embargo, hasta el momento no se dispone de una terapia dirigida que sea a la vez eficaz y segura para su uso clínico generalizado17.
- − Relajaciones del EEI asociadas a la deglución
- Aproximadamente entre el 5% y el 10% de los episodios de reflujo ocurren durante las relajaciones del EEI inducidas por la deglución. La mayoría de estos episodios se asocian a peristalsis defectuosa o incompleta. Durante una relajación del EEI inducida por la deglución, en condiciones normales, el reflujo es poco común debido a que el diafragma crural no se relaja, la duración de la relajación del EEI es relativamente breve (5 a 10 segundos) y la onda peristáltica que se aproxima actúa como barrera, impidiendo el reflujo18.
- El reflujo durante las relajaciones inducidas por la deglución es más frecuente en presencia de hernia hiatal. Esto podría explicarse por una menor distensibilidad de la UEG en los pacientes con hernia, lo que permite su apertura a presiones iguales o incluso inferiores a la presión intragástrica, facilitando así el reflujo del contenido gástrico acumulado dentro del saco herniario.
- − EEI hipotenso
- El reflujo gastroesofágico puede presentarse en el contexto de hipotensión del EEI, ya sea como reflujo inducido por esfuerzo o como reflujo libre. El reflujo inducido por esfuerzo ocurre cuando el EEI con una presión relativamente baja es superado por un aumento abrupto de la presión intraabdominal, como sucede al toser, hacer esfuerzos o agacharse. Este tipo de reflujo es poco probable cuando la presión del EEI es > 10 mmHg y no existe hernia hiatal19.
El reflujo libre se caracteriza por una caída del pH esofágico sin un cambio identificable en la presión intragástrica, y suele presentarse cuando la presión del EEI es < 5 mmHg. El reflujo debido a presión ausente o muy reducida del EEI es poco común; se observa típicamente en pacientes con esclerodermia en estadios avanzados y en aquellos que han sido sometidos a miotomía por acalasia. En general, ocurre en pacientes con esofagitis grave, en quienes puede representar hasta el 25% de los episodios de reflujo, y rara vez en pacientes sin esofagitis4.
Estos tres últimos mecanismos de reflujo se observan casi exclusivamente en presencia de hernia hiatal. Estas observaciones refuerzan el concepto de que la integridad funcional de la UEG depende tanto del EEI intrínseco como del componente esfinteriano extrínseco proporcionado por el hiato diafragmático. En esencia, el reflujo requiere dos «golpes» sobre la UEG. En los pacientes con una UEG anatómicamente normal, se necesita una inhibición simultánea del EEI y del diafragma crural para que ocurra el reflujo (es decir, a través de relajaciones transitorias del EEI). En cambio, cuando existe una hernia hiatal que compromete la función del esfínter crural, el reflujo puede producirse únicamente con la relajación del EEI, durante periodos de hipotensión esfinteriana, relajación inducida por deglución o maniobras de esfuerzo.
Alteraciones anatómicas: hernia hiatal
La presencia de hernia hiatal no implica la presencia de ERGE, pues muchos sujetos no tienen evidencia de ERGE a pesar de padecer hernia hiatal.
Sin embargo, la hernia hiatal es la anomalía anatómica más frecuente asociada con ERGE, y es significativamente más frecuente en pacientes con esofagitis erosiva en comparación con sujetos sanos20. Esta condición implica el desplazamiento axial del EEI y del fondo gástrico hacia el mediastino, separando la superposición funcional del EEI con el diafragma crural y eliminando el ángulo de His. Como resultado, la presión de cierre en la UEG disminuye y la exposición al reflujo ácido aumenta tanto en posición supina como durante las maniobras de esfuerzo o deglución.
La gravedad del reflujo muestra una correlación directa con el tamaño de la hernia hiatal. Los pacientes con hernias > 3 cm tienen mayor riesgo de esofagitis erosiva, esófago de Barrett y complicaciones como estenosis. La hernia también contribuye a un fenómeno denominado «re-reflujo», en el cual el contenido atrapado en el saco herniario retorna repetidamente al esófago tras cada deglución, dificultando el aclaramiento esofágico21.
Además, las hernias grandes deterioran la capacidad del diafragma crural de ejercer su función esfinteriana extrínseca y modifican la geometría de la válvula antirretorno, que son elementos clave en la competencia de la barrera antirreflujo.
Disfunción de los mecanismos de defensa esofágica
Una vez que ocurre el reflujo, la extensión del daño depende en gran medida de la eficacia de los mecanismos de defensa esofágicos, los cuales incluyen el aclaramiento ácido y la integridad de la mucosa esofágica.
Aclaramiento ácido esofágico
Este proceso tiene dos componentes: uno mecánico, mediado por la peristalsis primaria y secundaria, y otro químico, dado por la neutralización del ácido residual mediante la saliva rica en bicarbonato. En los pacientes con ERGE es habitual que la motilidad esofágica sea inefectiva, definida por contracciones peristálticas de baja amplitud (< 450 mmHg·cm/s) que contribuyen a un aclaramiento lento y prolongado. La hiposalivación, común durante el sueño y en fumadores, también retrasa la neutralización del ácido residual22–24.
Integridad de la mucosa
En condiciones normales, la mucosa esofágica actúa como una barrera que impide la difusión de sustancias irritantes hacia la submucosa. En la ERGE se ha observado una disminución de la impedancia esofágica basal y una dilatación de los espacios intercelulares, que permiten la activación de terminaciones nerviosas subepiteliales incluso con exposición ácida subumbral. Estos hallazgos explican la aparición de síntomas en pacientes con reflujo no erosivo o con pH-metría normal, y refuerzan la noción de que el daño epitelial no requiere necesariamente una esofagitis evidente7,8,25.
Eje esófago-cerebro
La percepción del reflujo es el resultado no solo de estímulos periféricos, sino también de su procesamiento en el sistema nervioso central (Fig. 1). En este sentido, el eje esófago-cerebro ha emergido como un componente central en la fisiopatología de la ERGE, especialmente en subgrupos con síntomas refractarios o en ausencia de correlación clínico-endoscópica8.
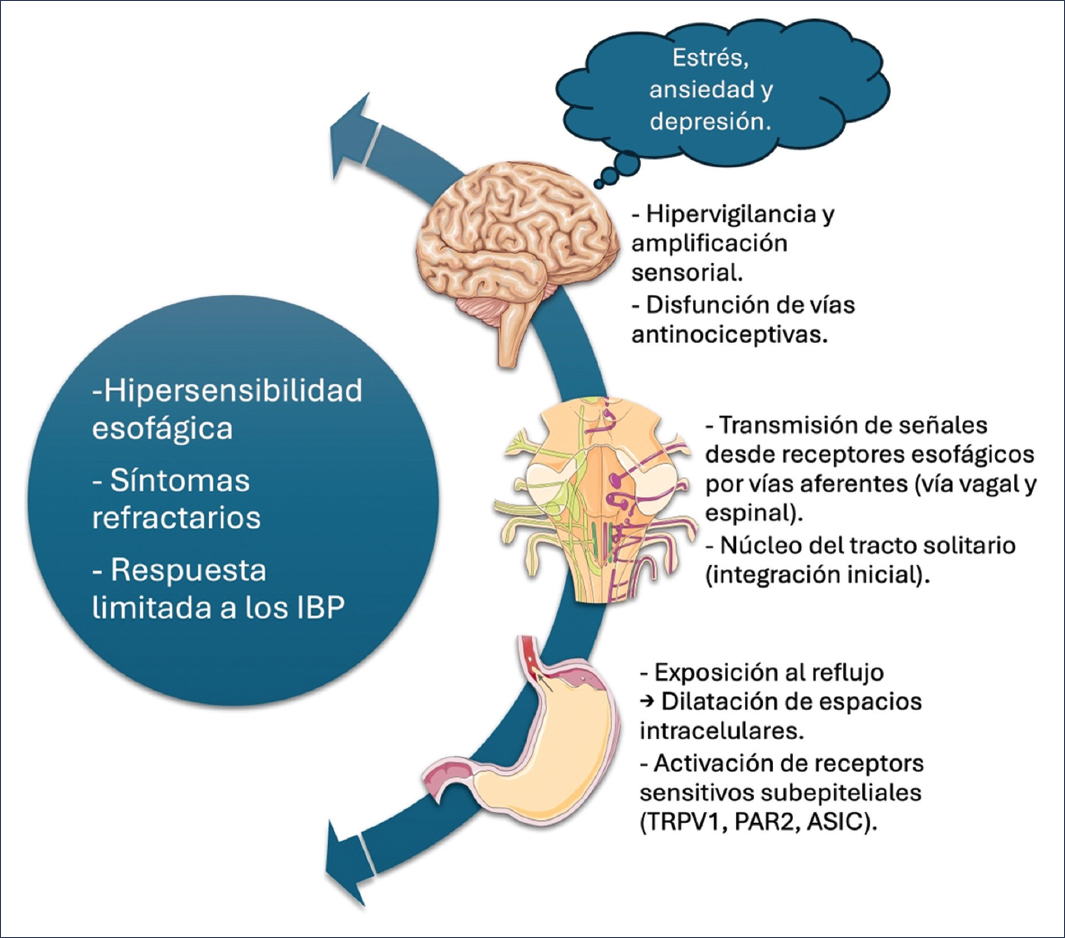
Figura 1. Interacciones del eje esófago-cerebro en la fisiopatología de la enfermedad por reflujo gastroesofágico (ERGE). El esquema ilustra la relación bidireccional entre el esófago y el sistema nervioso central en la percepción y la modulación de los síntomas de la ERGE. En el esófago, la exposición al reflujo provoca dilatación de los espacios intercelulares y activación de los receptores sensitivos subepiteliales (TRPV1, PAR2, ASIC), iniciando la transmisión de señales aferentes por vía vagal y espinal hacia el núcleo del tracto solitario para su integración. En el cerebro, la hipervigilancia, la amplificación sensorial y la disfunción de vías antinociceptivas contribuyen a la hipersensibilidad esofágica, mientras que el estrés, la ansiedad y la depresión modulan la percepción de los síntomas, resultando en síntomas refractarios y respuesta limitada a los inhibidores de la bomba de protones (IBP) (imagen elaborada utilizando elementos gráficos proporcionados por Servier Medical Art, bajo licencia Creative Commons Attribution 4.0 International).
Los estudios han demostrado que los pacientes con ERGE presentan una mayor sensibilidad a estímulos mecánicos, térmicos, químicos y eléctricos aplicados al esófago, fenómeno conocido como hipersensibilidad esofágica. Esto se debe a mecanismos tanto periféricos (aumento en la densidad o en la expresión de receptores TRPV1, PAR2 o ASIC) como centrales (hipervigilancia, amplificación sensorial y disfunción de las vías antinociceptivas descendentes)26.
El estrés, la ansiedad y la depresión modulan la actividad del eje esófago-cerebro, aumentando la percepción del reflujo e incluso induciendo cambios en la permeabilidad epitelial. La exposición al estrés agudo, por ejemplo, en estudios en animales se ha asociado con dilatación de los espacios intercelulares de la mucosa, lo que sugiere un vínculo directo entre lo emocional y lo fisiológico27,28.
Estos mecanismos explican por qué algunos pacientes presentan síntomas graves con mínimas alteraciones estructurales, y por qué la respuesta a los inhibidores de la bomba de protones es limitada en ciertas personas. El tratamiento en estos casos puede incluir neuromoduladores, psicoterapia cognitivo-conductual o técnicas de relajación.
Microbiota esofágica
La microbiota esofágica ha sido tradicionalmente poco estudiada, pero los análisis basados en técnicas de secuenciación 16S rRNA han revelado que existe una comunidad bacteriana diversa en el esófago, cuyo perfil puede variar en distintas condiciones clínicas29.
En los pacientes con ERGE y esófago de Barrett se ha observado un cambio en la composición microbiana, con un aumento relativo de microorganismos anaerobios gramnegativos, como Prevotella, Fusobacterium y Veillonella, en comparación con el predominio de Streptococcus en los individuos sanos30.
Se postula que estos cambios podrían inducir o perpetuar procesos inflamatorios a través de la activación de receptores tipo Toll, citocinas proinflamatorias y disrupción de la barrera epitelial31. También se ha sugerido una interacción de la microbiota alterada, la acidez intraluminal y la susceptibilidad a la metaplasia esofágica, aunque estos mecanismos aún no se comprenden por completo32.
El papel de la microbiota es un área emergente de investigación con potencial terapéutico, que abre la puerta a intervenciones futuras como el uso de probióticos, antibióticos dirigidos o moduladores del microbioma en el manejo personalizado de la ERGE.
Discusión
La fisiopatología de la ERGE representa un fenómeno complejo, dinámico y multifactorial. Si bien la secreción gástrica ácida desempeña un papel indiscutible, en las últimas décadas ha quedado claro que la mera presencia de ácido no es suficiente para explicar la diversidad clínica ni la gravedad de la enfermedad. En este artículo se han integrado los hallazgos funcionales, anatómicos, sensoriales y microbiológicos que permiten una comprensión más completa del proceso fisiopatológico.
Las relajaciones transitorias del EEI emergen como el principal mecanismo de reflujo en los individuos sin hernia hiatal. Esto se ha demostrado en estudios con manometría de alta resolución e impedancia, en los que la mayoría de los episodios de reflujo no se acompañan de hipotonía basal del EEI, sino de relajaciones transitorias del EEI repetitivas y prolongadas. Esta observación ha llevado a considerar las relajaciones transitorias del EEI, más que como una alteración patológica per se, como una respuesta exagerada o disfuncional frente a estímulos gástricos normales.
La hernia hiatal, por otro lado, representa un componente anatómico crítico. Su contribución a la ERGE no se limita a alterar la anatomía del EEI, pues también compromete la función del diafragma crural y la válvula antirretorno, disminuyendo la presión de cierre y aumentando la susceptibilidad al reflujo posprandial y nocturno. Estos hallazgos respaldan la intervención quirúrgica (como la funduplicatura) en los pacientes con hernia hiatal significativa y reflujo refractario.
En cuanto a los mecanismos de defensa esofágica, la evidencia actual destaca que la motilidad esofágica inefectiva y la hiposalivación contribuyen a la prolongación del tiempo de exposición ácida, exacerbando el daño mucoso. No obstante, el hallazgo más notable es que incluso pacientes con reflujo «fisiológico» pueden experimentar síntomas graves, debido a alteraciones en la integridad epitelial (como la dilatación de los espacios intercelulares), lo cual refuerza el concepto de hipersensibilidad esofágica como aspecto clave en la fisiopatología del reflujo no erosivo.
El eje esófago-cerebro ha cobrado importancia como modulador crítico de la percepción del reflujo. Numerosos estudios han demostrado que factores como la ansiedad, la depresión y la hipervigilancia sensorial amplifican la experiencia sintomática, independientemente del grado de exposición ácida. Esta dimensión neuropsicológica no solo explica por qué algunos pacientes presentan síntomas desproporcionados respecto a los hallazgos endoscópicos, sino también por qué responden mejor a los neuromoduladores que a los inhibidores de la bomba de protones.
Finalmente, el papel de la microbiota esofágica constituye una frontera emergente en la fisiopatología de la ERGE. Si bien los datos actuales aún son limitados, la evidencia preliminar sugiere que un microbioma alterado podría contribuir a la inflamación crónica, la permeabilidad epitelial y la progresión hacia esófago de Barrett. Esto introduce una nueva dimensión ecológica y terapéutica, en la que podrían incorporarse estrategias de modulación bacteriana al manejo integral de la enfermedad.
Conclusiones
La ERGE no puede entenderse exclusivamente como una alteración en la secreción gástrica ácida. Su fisiopatología refleja la interacción compleja de disfunciones anatómicas, fisiológicas, sensoriales y neuroinmunitarias.
Las relajaciones transitorias del EEI constituyen el principal mecanismo de reflujo en los pacientes sin anomalías anatómicas evidentes, mientras que la presencia de hernia hiatal desorganiza la barrera antirreflujo, exacerbando la gravedad del reflujo y su repercusión mucosa. A su vez, las alteraciones en el aclaramiento ácido y en la integridad de la mucosa explican la persistencia del daño epitelial incluso en situaciones de reflujo moderado.
El eje esófago-cerebro es una dimensión clave para comprender la variabilidad sintomática, la disociación clínico-endoscópica y la refractariedad terapéutica. La comorbilidad psiquiátrica y los mecanismos centrales de amplificación sensorial modifican la experiencia del reflujo, exigiendo enfoques diagnósticos y terapéuticos más integrales.
Finalmente, los hallazgos recientes sobre la microbiota esofágica sugieren que su composición puede influir en la inflamación, la permeabilidad epitelial y potencialmente en la carcinogénesis, abriendo nuevas perspectivas de investigación y tratamiento.
Una comprensión multidimensional de la fisiopatología de la ERGE es indispensable para una medicina de precisión. Futuras investigaciones deberán integrar biomarcadores funcionales, psicológicos y microbianos, así como validar intervenciones personalizadas más allá de la simple supresión ácida.
Financiamiento
El autor declara no haber recibido financiamiento para este estudio.
Conflicto de intereses
El autor declara no tener conflicto de intereses.
Consideraciones éticas
Protección de personas y animales. El autor declara que para esta investigación no se han realizado experimentos en seres humanos ni en animales.
Confidencialidad, consentimiento informado y aprobación ética. El estudio no involucra datos personales de pacientes ni requiere aprobación ética. No se aplican las guías SAGER.
Declaración sobre el uso de inteligencia artificial. El autor declara que no utilizó ningún tipo de inteligencia artificial generativa para la redacción de este manuscrito.
