Introducción: diferencias fisiopatológicas entre los subtipos de dispepsia funcional
La fisiopatología de la dispepsia funcional (DF) se considera multifactorial, por lo que resulta en un trastorno heterogéneo en el cual diferentes mecanismos fisiopatológicos subyacentes se asocian con diferentes perfiles de síntomas. La fisiopatología de la DF (Fig. 1) incluye anomalías gástricas, como vaciamiento gástrico retardado, alteraciones en la acomodación del fundus, hipersensibilidad a la distensión gástrica e hipersensibilidad al ácido duodenal y a la concentración de lípidos, así como un papel de los eosinófilos activados, ya que se ha establecido un vínculo causal entre los eosinófilos y la dismotilidad intestinal. Es imposible señalar un mecanismo patológico unificado que explique los síntomas de todos los pacientes con DF, entre los que se incluyen cambios en el estómago (deterioro de la función reguladora, vaciamiento gástrico retardado y alergias) y cambios en el duodeno (aumento de la sensibilidad ácida o lipídica duodenal e inflamación leve). Estas anomalías funcionales y estructurales pueden interactuar, e intervienen en el deterioro de la integridad de la mucosa, la disfunción de la barrera inmunitaria y la regulación anormal del eje intestino-cerebro1,2.
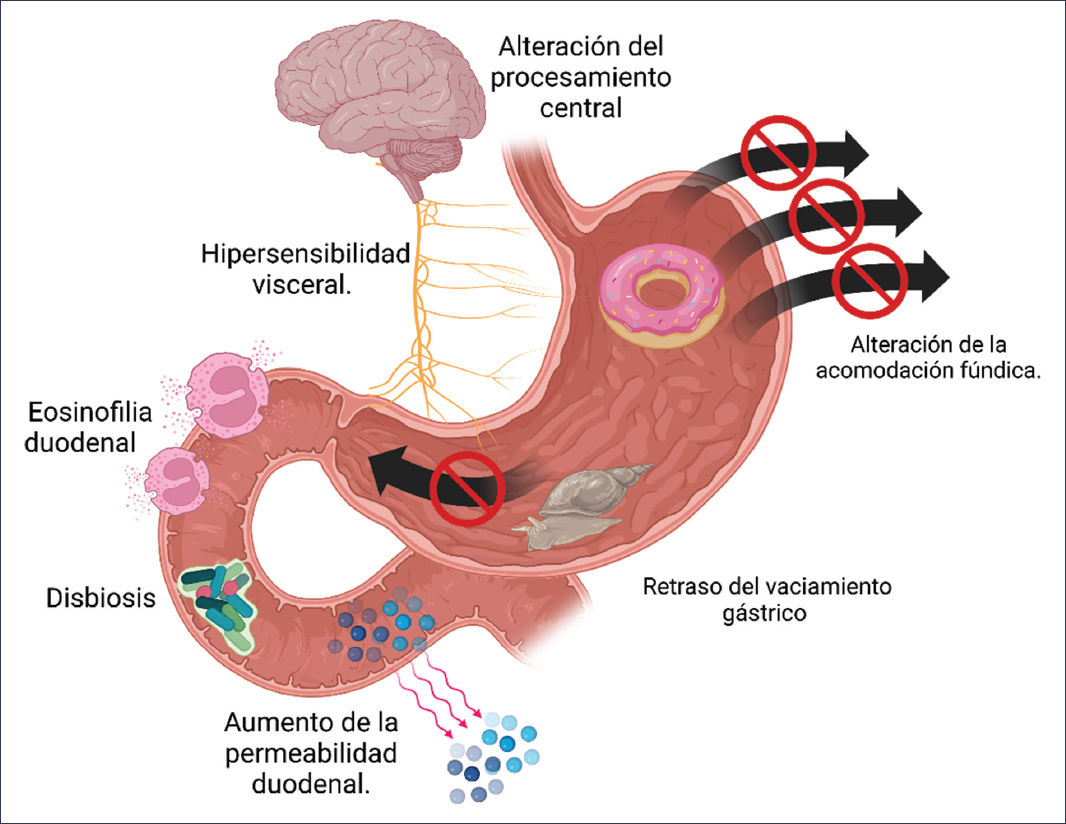
Figura 1. Fisiopatología de dispepsia funcional (creada con BioRender.com).
Hipersensibilidad visceral y alteraciones en la motilidad gástrica
Una alteración en la acomodación gástrica y un vaciamiento gástrico retardado son mecanismos fisiopatológicos fundamentales en la DF. La acomodación gástrica se encuentra deteriorada en un 15-50% de los pacientes, lo que se asocia con una capacidad reducida para la ingesta de líquidos, saciedad temprana, plenitud posprandial y pérdida de peso. A su vez, el vaciamiento gástrico en los pacientes con DF puede ser hasta 1.46 veces más lento que en controles sanos, y se ha relacionado con el sexo femenino, náuseas, vómitos y saciedad precoz.
Los pacientes con DF presentan además una actividad motora duodenal reducida ante la perfusión ácida, lo que favorece una mayor exposición al ácido duodenal. Esta alteración puede estar vinculada a una función eferente vagal disminuida, lo que sugiere que el nervio vago desempeña un papel esencial en el control de la motilidad gastrointestinal superior. El grado de disfunción sensitiva y motora gástrica condiciona la gravedad de los síntomas clínicos. La hipersensibilidad a la distensión gástrica se ha documentado en el 34-65% de los pacientes con DF, y los síntomas son más pronunciados en el periodo posprandial que en ayuno, lo cual se ha atribuido en parte al aclaramiento ácido duodenal retardado. También se ha descrito hipersensibilidad a estímulos químicos luminales, como el ácido y los lípidos, lo que condiciona una respuesta motora duodenal disminuida. Cabe mencionar que la alteración del tono vagal se asocia con vaciamiento gástrico retardado, y también la función duodenal alterada podría contribuir a la disfunción gástrica proximal, afectando tanto a la acomodación como al vaciamiento. Se ha demostrado que los pacientes con DF presentan umbrales disminuidos para la percepción del dolor durante la distensión del estómago proximal, lo que evidencia una hipersensibilidad visceral significativa. Esta puede deberse a sensibilización de vías nociceptivas, vías multimodales o ambas, resultando en una mayor intensidad de sensaciones tanto dolorosas como no dolorosas. Por último, se ha planteado que la hipersensibilidad visceral podría explicar los síntomas inducidos por antiinflamatorios no esteroideos AINE al interferir con la función mecanosensorial gástrica1,3–10.
Disfunción de la barrera epitelial gástrica, inflamación de bajo grado e intestino permeable
La disfunción de la barrera epitelial gástrica en la DF se ha vinculado a la inflamación de bajo grado y a procesos de piroptosis. Esta última es una forma inflamatoria de muerte celular que ocurre en respuesta a señales microbianas o de daño, y está mediada por el inflamasoma y la caspasa-1. Este fenómeno se ha relacionado con pérdida de integridad de la mucosa, lo que condiciona una mayor extrusión celular, permitiendo la translocación microbiana y la activación inmunitaria subepitelial. En pacientes con DF se han identificado anomalías estructurales y funcionales en la barrera duodenal. La pérdida de integridad epitelial y el incremento de la permeabilidad paracelular están asociados a síntomas como dolor epigástrico, distensión y saciedad precoz. La densidad de brechas epiteliales, un marcador de extrusión celular, ha sido validada como un indicador confiable de alteración de la barrera epitelial. La activación inmunitaria local involucra activación de mastocitos y eosinófilos que, al localizarse cerca de terminaciones nerviosas, podrían contribuir a la generación de síntomas. Se ha planteado que ciertos pacientes son más susceptibles a factores ambientales o luminales, los cuales desencadenan respuestas inmunitarias anómalas que deterioran las proteínas de unión celular y facilitan la penetración de antígenos y patógenos. Las interleucinas (IL), como IL-5 e IL-13, promueven la quimiotaxis de eosinófilos, perpetuando un ciclo inflamatorio que favorece la dismotilidad y la activación de linfocitos TH2; dicho proceso puede inducir necrosis axonal y alteración de la contractilidad del músculo liso gastrointestinal, contribuyendo a los síntomas dispépticos. También se ha descrito una infiltración linfoplasmocítica de bajo grado en la mucosa gástrica de algunos pacientes. En conjunto, estos hallazgos respaldan el papel de la inflamación de bajo grado y la disfunción epitelial como componentes clave en la fisiopatología de la DF, especialmente en subgrupos caracterizados por eosinofilia duodenal e integridad mucosa comprometida. Una barrera intestinal alterada permite la translocación de bacterias y productos microbianos al compartimento subepitelial, activando respuestas inmunitarias que pueden desencadenar inflamación neuroinmunitaria y contribuir a los síntomas dispépticos. En pacientes con DF se ha observado un incremento en la densidad de brechas epiteliales, una disminución en la impedancia mucosa duodenal y alteraciones en la expresión de proteínas de unión estrecha, como la zonulina. También la activación de células de Paneth, la secreción de defensinas, la disbiosis y la exposición a toxinas o componentes dietéticos contribuyen al deterioro de la función de barrera. Estas alteraciones facilitan la penetración de antígenos luminales, los cuales pueden activar células inmunitarias de la mucosa y desencadenar inflamación de bajo grado, sensibilización neuronal y disfunción motora. Asimismo, la vía paracelular, regulada por las uniones estrechas, puede verse afectada por mediadores inflamatorios, como la triptasa y la proteína básica mayor, liberados por mastocitos y eosinófilos. Estos mediadores aumentan la permeabilidad y perpetúan el círculo vicioso de activación inmunitaria y disfunción de la barrera. La evidencia actual indica que el aumento de la permeabilidad intestinal podría ser tanto una causa como una consecuencia de la DF. Sin embargo, aún se debate si representa un fenómeno primario o un epifenómeno derivado de procesos inflamatorios subyacentes.
Los estudios han mostrado que la restauración de la barrera epitelial podría aliviar los síntomas, aunque los datos clínicos en humanos son limitados y requieren validación adicional.
En conclusión, el leaky gut representa un componente importante en la fisiopatología de la DF en un subgrupo de pacientes, asociado con inflamación mucosa leve, disbiosis, activación inmunitaria y disfunción de la barrera. Su caracterización más precisa permitirá el desarrollo de estrategias terapéuticas personalizadas dirigidas a la restauración de la integridad de la mucosa intestinal2,5,11–22.
Dispepsia funcional posinfecciosa
La DF posinfecciosa se presenta tras episodios de gastroenteritis aguda y se ha asociado con una respuesta inmunitaria alterada tanto local como sistémica. La prevalencia estimada de DF posinfecciosa es de aproximadamente un 9.6% en los adultos, y los agentes etiológicos con más frecuencia implicados son Norovirus, Giardia lamblia, Salmonella spp., Escherichia coli O157 y Campylobacter spp. En contraste, Helicobacter pylori no parece estar vinculado a la DF de origen posinfeccioso. Los cambios persistentes en las células inmunitarias de la mucosa duodenal, como la activación de macrófagos y el receptor de quimiocina 2, y la acumulación de eosinófilos, sugieren una respuesta inflamatoria prolongada. Esta puede sensibilizar terminales nerviosas aferentes a través de la liberación de mediadores como las prostaglandinas, lo que contribuye a la aparición de síntomas dispépticos, en particular el ardor epigástrico. Durante la infección aguda se observa un incremento en la secreción de quimiocinas y de mediadores inflamatorios, como la histamina y la proteína quimioatrayente de monocitos-1. Estos factores promueven la activación de macrófagos y la migración de células inmunitarias hacia la mucosa duodenal, perpetuando la inflamación de bajo grado que puede mantenerse incluso después de la resolución del proceso infeccioso. Estos hallazgos respaldan la hipótesis de que la DF posinfecciosa resulta de una incapacidad del sistema inmunitario para resolver adecuadamente una agresión infecciosa inicial, lo que conlleva una activación inmunitaria crónica en la mucosa y el desarrollo de síntomas dispépticos persistentes1,3,16.
Eosinofilia duodenal
Diversos estudios han evidenciado un aumento de los eosinófilos y de los mastocitos activados en la mucosa duodenal de pacientes con DF, lo cual se ha correlacionado con un deterioro de la integridad epitelial, alteraciones en la expresión de proteínas de adhesión intercelular y cambios estructurales y funcionales en el plexo submucoso. La inflamación leve de la mucosa duodenal, caracterizada por infiltración eosinofílica y aumento de la permeabilidad epitelial, se ha identificado hasta en el 40% de los pacientes con DF. Esta infiltración se acompaña de un incremento en la densidad de espacios epiteliales, lo que refleja una alteración significativa de la barrera mucosa. Asimismo, se ha demostrado que los pacientes con DF y deterioro de la integridad duodenal presentan síntomas más intensos, como saciedad temprana, plenitud posprandial y dolor abdominal. La interacción de los eosinófilos y los mastocitos desempeña un papel central en la fisiopatología. La serotonina, liberada por los mastocitos, actúa como potente quimioatrayente de eosinófilos, los cuales, al degranularse, liberan proteínas, como la proteína básica mayor, que pueden aumentar la reactividad del músculo liso y activar aún más mastocitos y basófilos. Esta sinergia puede explicar parte del dolor abdominal en los pacientes sin hallazgos orgánicos. Los gránulos de eosinófilos contienen mediadores citotóxicos, como la proteína catiónica, la neurotoxina derivada de eosinófilos y la peroxidasa, que son tóxicos para el epitelio intestinal y contribuyen a la dismotilidad y a la alteración de la relajación gástrica. Durante su activación, estos gránulos pueden observarse en la lámina propia, en asociación con fibras nerviosas del duodeno, lo cual refuerza la conexión entre la inflamación de bajo grado y la sensibilización visceral. La duodenitis microscópica se ha detectado en más del 60% de las biopsias de pacientes con DF, y su presencia se ha vinculado significativamente con la infección por H. pylori; la infiltración eosinofílica es más pronunciada en pacientes positivos para esta bacteria. Además, se ha descrito una activación inmunitaria sistémica concurrente; si bien los eosinófilos forman parte normal de la lámina propia intestinal y participan en funciones inmunitarias homeostáticas, su activación excesiva y degranulación promueven el daño tisular y la remodelación epitelial. Se han identificado tres mecanismos de degranulación: exocitosis, citólisis y degranulación fragmentada. La IL-5 y la IL-13 amplifican este proceso inflamatorio, lo que refuerza su potencial papel patogénico en la DF2,5,12,16.
Influencia del sistema nervioso central y el eje intestino-cerebro
La DF se ha asociado frecuentemente con trastornos psicológicos como ansiedad y depresión, los cuales parecen influir en la gravedad de los síntomas. Varios estudios han demostrado una correlación entre las puntuaciones en cuestionarios de psicopatología y la intensidad del malestar gastrointestinal.
La hipersensibilidad visceral puede originarse no solo por sensibilización periférica, sino también por alteraciones en el procesamiento central de las señales viscerales aferentes. La actividad anormal de regiones cerebrales implicadas en la modulación del dolor, como la corteza cingulada anterior, la ínsula, el tálamo, la corteza prefrontal y el hipocampo, se ha reportado consistentemente en pacientes con DF. Estas áreas forman parte del circuito del dolor visceral.
Durante la distensión gástrica, los pacientes con DF muestran mayor activación de la corteza prefrontal, la ínsula, la corteza cingulada anterior y el tálamo en comparación con controles sanos. Esta hiperactivación cerebral podría deberse a la anticipación de dolor visceral o a la memoria de experiencias negativas previas. El aumento en la respuesta de la ínsula sugiere un rol clave en la percepción interoceptiva alterada en estos pacientes.
El eje intestino-cerebro se encuentra implicado no solo en la percepción sensorial, sino también en la modulación autonómica y emocional. Se ha observado que la ansiedad puede amplificar la actividad cerebral en respuesta a estímulos viscerales, mientras que la depresión se asocia con disfunción del procesamiento afectivo y cognitivo del dolor. Estas alteraciones podrían explicar en parte la disfunción sensoriomotora gastrointestinal observada en la DF. Los estudios de neuroimagen han demostrado alteraciones en la conectividad funcional y estructural del cerebro en los pacientes con DF, incluyendo cambios en el metabolismo cerebral regional y en la sustancia blanca. La desactivación inadecuada de la amígdala y la falta de activación de la corteza cingulada pregenual durante la estimulación visceral se han interpretado como un fallo en la modulación descendente del dolor mediada por procesos cognitivo-afectivos. Además, se ha propuesto un modelo biopsicosocial que integra los factores psicológicos con la fisiopatología de la DF. La ansiedad y la depresión podrían promover una mayor percepción de señales viscerales fisiológicas, alterando el procesamiento homeostático e interoceptivo. Estas alteraciones podrían estar asociadas a un hipermetabolismo en regiones como la corteza prefrontal, la ínsula y la corteza cingulada anterior, identificado mediante estudios de glucometabolismo cerebral.
En conjunto, la DF podría considerarse un síndrome de dolor funcional crónico caracterizado por una alteración de la modulación del dolor a nivel central y una disfunción del eje intestino-cerebro. Estos hallazgos refuerzan la importancia de incorporar la evaluación de los aspectos psicológicos en el abordaje diagnóstico y terapéutico de los pacientes con DF, incluyendo intervenciones farmacológicas o psicoterapéuticas dirigidas a estos procesos1,11,15,17,18.
Papel de la microbiota gástrica e intestinal en la dispepsia funcional
La microbiota gástrica e intestinal ha emergido como un componente relevante en la fisiopatología de la DF. Se ha observado una disbiosis específica en la mucosa duodenal de pacientes con DF, caracterizada por un aumento en la abundancia relativa de Streptococcus y una disminución de géneros anaerobios como Prevotella, Veillonella y Actinomyces. Esta alteración se ha correlacionado con mayor carga bacteriana y menor diversidad microbiana. La carga bacteriana de la mucosa duodenal se ha vinculado negativamente con la calidad de vida, y su incremento se ha asociado con mayor gravedad de los síntomas posprandiales. Además, se ha reportado una relación inversa entre la abundancia de Streptococcus y de géneros anaerobios, lo que sugiere un desequilibrio ecológico que puede contribuir a la inflamación leve y a la disfunción de la barrera epitelial. Filogenéticamente, se ha descrito un aumento de Proteobacteria y una disminución de Actinobacteria, Bacteroidetes y Firmicutes en pacientes positivos para H. pylori. Estos cambios podrían influir en la motilidad y la inmunorreactividad mucosa, exacerbando la sintomatología dispéptica. Por otro lado, se han identificado ciertos taxones bacterianos con posibles asociaciones causales con la DF. El grupo Clostridium innocuum y el género Ruminiclostridium 9 mostraron una correlación positiva con el riesgo de DF, mientras que el grupo FCS020 del género Lachnospiraceae se asoció negativamente. Lachnospiraceae, productores de ácidos grasos de cadena corta, podrían tener un efecto protector al favorecer la homeostasis intestinal y reducir la permeabilidad duodenal. Los metabolitos derivados de la microbiota intestinal, como los ácidos biliares secundarios, los ácidos grasos de cadena corta y los neurotransmisores, participan en la señalización del eje intestino-cerebro y podrían modular tanto la función digestiva como la percepción visceral. Esta interacción sugiere que la disbiosis podría no solo ser consecuencia, sino también contribuyente activo en la patogénesis de la DF. En conjunto, estos hallazgos respaldan el potencial papel de la microbiota gástrica e intestinal como modulador clave de la DF, abriendo la posibilidad de estrategias terapéuticas dirigidas al microbioma, incluyendo el uso de probióticos, prebióticos o intervenciones dietéticas específicas2,15,19,20.
Conclusiones
La DF constituye un síndrome complejo y heterogéneo, en el que convergen múltiples mecanismos fisiopatológicos que interactúan de manera dinámica para generar un amplio espectro de síntomas. El análisis integrador de la evidencia disponible confirma que no existe un único proceso patológico capaz de explicar todos los casos, sino que se trata de una condición multifactorial en la que alteraciones motoras, sensoriales, inmunitarias, inflamatorias y microbianas se combinan de forma variable según el paciente.
Las alteraciones de la motilidad y la hipersensibilidad visceral representan ejes centrales de la enfermedad, afectando tanto a la acomodación y el vaciamiento gástrico como a la respuesta a estímulos químicos y mecánicos luminales. Estos cambios no ocurren de manera aislada, sino que se potencian mutuamente con fenómenos de sensibilización periférica y central, en estrecha relación con la actividad del eje intestino-cerebro y con factores emocionales como la ansiedad y la depresión, que pueden amplificar la percepción de los síntomas.
La integridad de la barrera epitelial emerge como otro pilar fisiopatológico. El incremento de la permeabilidad intestinal, la activación de células inmunitarias residentes (eosinófilos y mastocitos) y la inflamación de bajo grado generan un entorno propicio para la disfunción sensoriomotora. En este contexto, el leaky gut no debe entenderse únicamente como un hallazgo secundario, sino como un fenómeno que puede iniciar o perpetuar la cascada de eventos patológicos, particularmente en subgrupos con predisposición genética o susceptibilidad ambiental.
La DF posinfecciosa y la eosinofilia duodenal ilustran cómo una agresión inicial puede desencadenar una respuesta inflamatoria persistente, con remodelación epitelial, alteración de la permeabilidad y sensibilización de las vías aferentes. Estos hallazgos apoyan la hipótesis de que la inflamación residual de la mucosa puede constituir un marcador pronóstico y un blanco terapéutico relevante.
Asimismo, la caracterización de la microbiota gástrica e intestinal ha revelado que la disbiosis podría desempeñar un papel dual como consecuencia y como factor contribuyente a la DF. La composición bacteriana alterada, la disminución de la diversidad microbiana y el cambio en metabolitos bioactivos sugieren que la modulación del microbioma podría convertirse en un enfoque terapéutico emergente, con potencial para restaurar la homeostasis mucosa y mejorar la sintomatología.
En conjunto, la DF debe entenderse como un síndrome de interacción múltiple, en el que se entrelazan disfunciones motoras y sensoriales, inflamación de bajo grado, disbiosis y alteraciones del procesamiento central del dolor. Esta visión integradora refuerza la necesidad de un abordaje diagnóstico y terapéutico individualizado, que considere tanto los mecanismos periféricos como los centrales, así como los factores psicosociales y ambientales que condicionan la expresión clínica. El futuro del manejo de la DF se orienta hacia estrategias personalizadas, con terapias dirigidas a subfenotipos bien caracterizados, combinando intervenciones farmacológicas, dietéticas, microbiológicas y psicológicas. Solo así será posible avanzar hacia un control sintomático efectivo y sostenido, mejorando la calidad de vida de quienes padecen este complejo trastorno.
Financiamiento
Los autores declaran no haber recibido financiamiento para este estudio.
Conflicto de intereses
Los autores declaran no tener conflicto de intereses.
Consideraciones éticas
Protección de personas y animales. Los autores declaran que para esta investigación no se han realizado experimentos en seres humanos ni en animales.
Confidencialidad, consentimiento informado y aprobación ética. El estudio no involucra datos personales de pacientes ni requiere aprobación ética. No se aplican las guías SAGER.
Declaración sobre el uso de inteligencia artificial. Los autores declaran que no utilizaron ningún tipo de inteligencia artificial generativa para la redacción de este manuscrito.
