Introducción
La dispepsia funcional (DF) y la gastroparesia (Gp) representan un reto para el gastroenterólogo, ya que ambas se caracterizan por síntomas gastrointestinales altos como dolor epigástrico, saciedad temprana y náusea; con la diferencia de que la DF se diagnostica por criterios clínicos (después de haber realizado una endoscopia digestiva superior), mientras que la Gp requiere una medición objetiva del tiempo de vaciamiento gástrico (VG) en ausencia de obstrucción mecánica1. El objetivo principal de esta revisión es exponer las diferencias y las similitudes entre la DF y la Gp, tomando en cuenta la evidencia científica disponible al respecto.
Gastroparesia y dispepsia funcional: estableciendo diferencias y similitudes
La Gp es una condición crónica (al menos 3 meses de evolución) cuyo síntoma más común es la náusea, la cual está presente en el 95% de los casos, seguido del vómito2. Por lo tanto, el predominio de náusea y vómito sobre los síntomas de dolor epigástrico y malestar posprandial puede orientar más hacia el diagnóstico de Gp que de DF. En un estudio observacional se incluyeron 225 pacientes con retraso del VG, de los cuales el 54% tenían Gp idiopática, el 27% Gp diabética, el 11% Gp atípica y el 8% Gp posquirúrgica. A estos pacientes se les aplicaron los cuestionarios PAGI-SYM (Patient Assessment of upper Gastrointestinal Symptoms), que valora la gravedad de los síntomas gastrointestinales en la Gp, la DF y la enfermedad por reflujo gastroesofágico (ERGE), y R4DQ (Rome IV Diagnostic Questionnaire) para diagnosticar trastornos digestivos funcionales. En promedio, los pacientes con Gp cumplieron los criterios de Roma IV para dos trastornos de la interacción del eje cerebro-intestino, siendo los más frecuentes la DF en el 90.8% y el síndrome de náusea y vómito crónico en el 83%. Respecto a los subtipos de DF, el síndrome de distrés posprandial se presentó en el 88% y el síndrome de dolor epigástrico en el 59.8%. No se encontró una diferencia significativa en la gammagrafía de VG, ni por etiología de la Gp ni por subtipo de DF3.
El diagnóstico de Gp con frecuencia se realiza de forma equivocada, aunque actualmente se sabe que con el tiempo los pacientes pueden fluctuar entre Gp y DF. En un estudio retrospectivo realizado en la Clínica Mayo de Jacksonville, de 2019 a 2021 se evaluaron 339 pacientes que fueron referidos por Gp y se analizó cuáles fueron los diagnósticos finales. En el 89% de los casos, el síntoma más frecuente fue la náusea, seguido de dolor abdominal (76%), estreñimiento (70%), vómito (65%), distensión subjetiva (37.5%) y saciedad temprana (34%). El diagnóstico de Gp solo se confirmó en el 19.5% de los casos, mientras que el 80.5% recibieron un diagnóstico diferente, siendo la DF el diagnóstico alternativo más común (44.5%), seguido del VG acelerado (12%), la disfunción del piso pélvico (9.9%), el estreñimiento (8.4%), el síndrome de hiperémesis por cannabinoides (7%) o inducido por fármacos (5.1%), el síndrome de náusea y vómito crónico (3%), el síndrome de ligamento arcuato mediano (2.6%) y el síndrome de la arteria mesentérica superior (1%)4. Este estudio resalta la importancia de considerar diagnósticos diferenciales cuando se evalúa a un paciente con síntomas de dismotilidad gástrica.
En cuanto a los factores de riesgo para la DF y la Gp, existen algunos en común, como la etiología posinfecciosa. Está establecido que, después de una infección gastrointestinal, la prevalencia media de DF posinfecciosa es del 9.5%, con una odds ratio de 2.54 a más de 6 meses del evento en comparación con un grupo control, siendo los agentes etiológicos más frecuentes Salmonella spp., Escherichia coli O157, Campylobacter jejuni, Giardia lamblia y Norovirus5. Por su parte, en la Gp posinfecciosa la evidencia es menos fuerte y los datos provienen de series de casos y de estudios retrospectivos. Un aspecto que está demostrado en este sentido es que los pacientes con Gp posviral tienden a presentar una mejoría gradual de los síntomas, requieren menos hospitalizaciones y mantienen un peso estable, en comparación con los casos idiopáticos, que presentan síntomas progresivos y deterioro de la calidad de vida6.
A diferencia de la DF, en la Gp existen causas secundarias, como farmacológicas (opiáceos, agonistas del receptor del péptido similar al glucagón 1), enfermedades del tejido conectivo (esclerosis sistémica, lupus eritematoso sistémico), posquirúrgicas (funduplicatura, vagotomía, cirugía bariátrica) y neurológicas (enfermedad de Parkinson, disautonomía)7.
La fisiopatología de la DF es compleja y multifactorial, destacando alteraciones en la motilidad y la acomodación gástricas, hipersensibilidad visceral, factores alimentarios y aspectos psicosociales, los cuales a su vez se encuentran presentes en los pacientes con Gp (Fig. 1). Incluso, si tomamos en cuenta que el retraso en el VG es lo que distingue la Gp de la DF, cabe destacar que hasta un 25-30% de los pacientes con DF pueden presentarlo8.
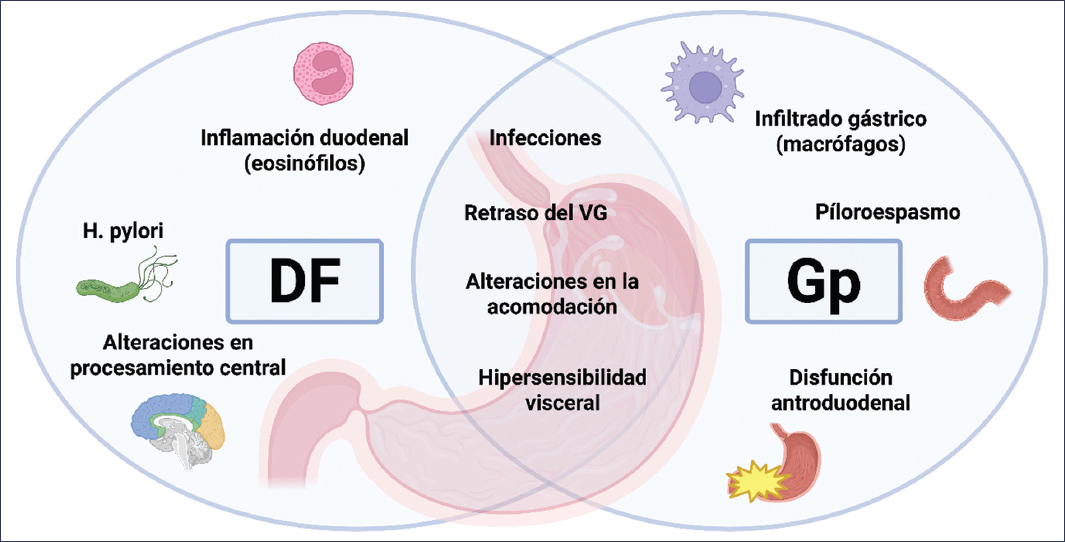
Figura 1. Mecanismos fisiopatológicos de la dispepsia funcional (DF) y de la gastroparesia (Gp). VG: vaciamiento gástrico.
El retraso en el VG parece ser un proceso dinámico que puede cambiar con el tiempo y, por lo tanto, los pacientes en su evolución pueden pasar de tener Gp a DF, y viceversa. El Gastroparesis Clinical Research Consortium (GpCRC) publicó un estudio en el año 2021 en el cual incluyeron 944 pacientes en un periodo de 12 años, de los cuales el 76% cumplían criterios para Gp por gammagrafía, mientras que el 24% tenían VG normal y cumplían criterios para DF. Todos presentaban similares características clínicas y gravedad de los síntomas gastrointestinales. Un año después, el 42% de los pacientes que inicialmente tenían Gp fueron reclasificados como DF de acuerdo con los resultados del estudio de VG en ese momento; por el contrario, se reclasificó como Gp al 37% de los pacientes que al inicio tenían DF. Una de las explicaciones de los autores a este evento es la falta de reproducibilidad de los estudios de VG, debido a limitaciones intrínsecas en la metodología de la prueba y a variaciones en su interpretación. También es posible que, en ciertos pacientes, la tasa de VG fluctúe a medida que evoluciona la enfermedad. Los cambios en el diagnóstico no se asociaron a cambios en la gravedad de los síntomas. Un hallazgo interesante fue que en ambos grupos se encontró una pérdida de células intersticiales de Cajal y de macrófagos DC206+ en comparación con controles obesos9.
Un concepto importante es que el VG no se asocia a gravedad de los síntomas ni incluso con la respuesta a procinéticos, tanto en la DF como en la Gp. Esto fue expuesto por Carbone et al.10 en un estudio retrospectivo en 504 pacientes, de los cuales 382 tenían un VG normal y 122 un VG retrasado (clasificados como Gp idiopática). Durante una prueba de aliento con C13 se fueron valorando cada 15 minutos seis síntomas: plenitud posprandial, dolor y ardor epigástrico, distensión, náusea y eructos. De estos, solo la náusea fue significativamente mayor en los pacientes con VG retrasado (p = 0.01), sin observar correlación entre la tasa de VG y los demás síntomas. Se concluye que, en los pacientes con DF y Gp, la gravedad de los síntomas no se correlaciona con la tasa de VG10.
Parece ser que otros mecanismos fisiopatológicos, como la acomodación gástrica y la hipersensibilidad a la distensión, se correlacionan mejor con los síntomas. Mediante baróstato y ultrasonido 3D, se compararon pacientes con DF (n = 15) y sujetos sanos (n = 15), y se evaluó la relación entre los volúmenes gástricos y los síntomas. En la prueba con baróstato, los pacientes con DF tuvieron volúmenes posprandiales menores (200 ml de Nutridrink®) que los sujetos sanos (p = 0.001), además de presentar una alteración en la acomodación gástrica proximal. Los resultados con ultrasonido 3D demostraron una diferencia en cuanto a la distribución del volumen proximal y distal; en los pacientes con DF el volumen proximal (fundus) fue significativamente menor y el distal (antro) significativamente mayor, en comparación con los controles sanos. Esto se asoció con saciedad temprana y plenitud posprandial11].
Esta alteración en la acomodación gástrica proximal fue evaluada también en pacientes con Gp idiopática en los que se realizaron estudios con baróstato. De 58 pacientes con retraso del VG grave, el 43% tuvieron alteración en la acomodación gástrica, lo cual se correlacionó con una mayor prevalencia de saciedad temprana (p < 0.005) y pérdida de peso (p < 0.009). La hipersensibilidad a la distensión gástrica se asoció con un aumento en la prevalencia de dolor epigástrico, saciedad temprana y pérdida de peso. Al igual que en estudios previos, el patrón sintomático no estuvo determinado por el retraso en el VG12.
Un mecanismo adicional involucrado en la DF es la presencia de eosinófilos en el duodeno, especialmente en relación con el síndrome de distrés posprandial. En un estudio prospectivo que incluyó 22 pacientes con DF y 22 controles sanos, se evaluó la cantidad de eosinófilos en el bulbo duodenal (D1) y en la segunda porción del duodeno (D2). Los resultados mostraron un aumento en el número de eosinófilos en D2 en los pacientes con síntomas de malestar posprandial13. En los pacientes con Gp hubo un incremento en la cantidad de macrófagos en el cuerpo gástrico, lo cual puede corresponder a una etapa inicial de la fisiopatología.
En modelos animales se han implicado algunos polimorfismos con Gp, como el polimorfismo en el gen HMOX-1, el cual codifica para la hemooxigenasa y se expresa en macrófagos activados (CD206+)14.
Al igual que en la DF, los pacientes con Gp suelen presentar alteraciones psicológicas, las cuales influyen significativamente en la intensidad de los síntomas clínicos. En un estudio realizado por Hasler et al.15 se administraron los cuestionarios Beck Depression Inventory (BDI) y State-Trait Anxiety Inventory (STAI) a una cohorte de 299 pacientes con Gp. Los resultados mostraron una correlación positiva entre la gravedad de los síntomas y los puntajes obtenidos en ambos instrumentos, indicando niveles más altos de ansiedad y depresión en los casos más graves. Además, estos puntajes elevados se vincularon con un mayor consumo de medicamentos psicotrópicos, como ansiolíticos y antidepresivos. Cabe destacar que dichas asociaciones no mostraron relación con la etiología subyacente de la Gp ni con el grado de retención gástrica evidenciado15.
El tratamiento de la DF y la Gp se orienta principalmente al alivio sintomático y a la mejora de la calidad de vida del paciente. En el caso de la DF, se aconsejan modificaciones en el estilo de vida, que incluyen la eliminación del consumo de alcohol y tabaco, así como la reducción de la ingesta de alimentos ricos en grasas. En los pacientes con Gp diabética se ha observado que una dieta compuesta por partículas pequeñas puede contribuir a disminuir los síntomas asociados con el VG retardado y el reflujo gastroesofágico. No obstante, la evidencia disponible sobre la eficacia de las intervenciones dietéticas en estos trastornos es limitada y de baja calidad metodológica, lo que impide establecer recomendaciones firmes2,16.
Los inhibidores de la bomba de protones han demostrado ser eficaces en el manejo sintomático del síndrome de dolor epigástrico, logrando una mejoría clínica en aproximadamente el 34% de los pacientes tratados, en comparación con el 25% en el grupo que recibió placebo, lo que se traduce en un número necesario a tratar estimado entre 7 y 14. En el contexto de la Gp, la utilización de inhibidores de la bomba de protones solo está indicada en presencia de comorbilidad con ERGE, condición que se reporta en más del 50% de los pacientes con Gp2,16.
Los procinéticos son efectivos para los síntomas asociados con dismotilidad, tanto en la DF como en la Gp. El término «procinético» se refiere a que mejora la motilidad y el tránsito del contenido gastrointestinal, principalmente, al amplificar y coordinar las contracciones musculares. Estos fármacos ejercen su mecanismo de acción mediante un efecto directo sobre el músculo intestinal o a través de la activación de su inervación excitatoria17.
En 2022, el GpCRC publicó un estudio de cohorte dinámico que evaluó los efectos de la domperidona sobre los síntomas de Gp. En la muestra analizada, el 75% de los participantes presentaban diagnóstico de Gp, y de estos, el 63% eran casos idiopáticos, mientras que el 25% restante manifestaban síntomas compatibles con Gp, pero con VG dentro de rangos normales. El estudio incluyó un total de 748 pacientes, de los cuales 181 (24%) recibieron tratamiento con domperidona, con una dosis promedio de 40 mg diarios, y 567 conformaron el grupo sin domperidona. Al comparar los resultados clínicos entre ambos grupos, aquellos que recibieron domperidona mostraron una mejoría estadísticamente significativa en múltiples aspectos, como puntuación total del índice de síntomas de gastroparesia (p = 0.003), náusea (p = 0.003), plenitud (p = 0.005), dolor abdominal superior (p = 0.04), puntuación asociada a ERGE (p = 0.05) y calidad de vida global (p = 0.05)18.
La prucaloprida, un agonista 5-HT4 aprobado para el tratamiento del estreñimiento crónico, fue evaluada en estudio doble ciego, cruzado, en 34 pacientes con Gp (28 idiopáticas, 7 hombres) que fueron aleatorizados para recibir durante 4 semanas prucaloprida, 2 mg cuatro veces al día, o placebo, seguido de un periodo de lavado de 2 semanas. En comparación con el placebo, la prucaloprida mejoró significativamente el índice de síntomas de gastroparesia (1.65 ± 0.19 vs. 2.28 ± 0.20; p < 0.0001) y las subescalas de saciedad/plenitud, náusea/vómito e hinchazón/distensión19.
El velusetrag, otro agonista 5-HT4 pangastrointestinal y selectivo, está siendo estudiado en diferentes trastornos motores digestivos. En un estudio multicéntrico, en pacientes con Gp, el tratamiento con velusetrag a dosis de 30 mg aumentó significativamente la proporción de sujetos con una reducción ≥ 20% en el tiempo medio de VG, en comparación con placebo20.
En la Gp existen factores que predicen la respuesta al tratamiento farmacológico, siendo las de etiología viral, idiopática y diabética las que responden mejor a los procinéticos. Por el contrario, las secundarias a vagotomía o trastornos del tejido conectivo, y en los pacientes diabéticos con evidencia de neuropatía vagal, la eficacia de los procinéticos suele ser subóptima21.
Los neuromoduladores, en especialmente los antidepresivos tricíclicos y los inhibidores selectivos de la recaptura de serotonina, modulan los niveles de serotonina y, por lo tanto, tienen efecto sobre la motilidad y la nocicepción visceral. Se recomiendan tanto en la DF como en la Gp como tratamiento de segunda línea4,22. La eficacia de la mirtazapina, a dosis de 15 mg al día, fue evaluada en pacientes con Gp y pobre control de síntomas. Durante un periodo de seguimiento de 4 semanas, se observaron mejoras estadísticamente significativas en varios síntomas cardinales de la enfermedad, incluyendo náuseas, vómitos, arcadas y la percepción de pérdida del apetito, tanto a las 2 como a las 4 semanas de tratamiento23. En la DF, la mirtazapina se recomienda sobre todo en pacientes con malestar posprandial acompañado de pérdida de peso16,22.
Las intervenciones endoscópicas, indicadas solo en la Gp y no en la DF, incluyen la inyección intrapilórica de toxina botulínica, la cual ha demostrado mejoría de los síntomas a corto plazo (< 6 meses), sin impacto en la tasa de VG24. La piloromiotomía peroral endoscópica tiene una tasa de éxito clínico a 12 meses del 56%, con una efectividad moderada en el tratamiento de la Gp; por lo tanto, se debe considerar en casos seleccionados con síntomas más graves y en aquellos pacientes que responden a la inyección de toxina botulínica25,26.
Finalmente, la estimulación gástrica eléctrica, mediante el sistema Enterra®, está aprobada por la Food and Drug Administration de los Estados Unidos de América bajo la categoría de dispositivo de uso humanitario. Esta clasificación se aplica a tecnologías destinadas al tratamiento de condiciones que afectan a menos de 8000 personas al año en ese país. La evidencia disponible sugiere que este abordaje terapéutico puede inducir una mejoría en síntomas específicos, como náuseas, vómitos y pérdida del apetito, en pacientes con Gp refractaria. Sin embargo, los estudios realizados hasta la fecha no han mostrado un impacto significativo en parámetros más globales como la calidad de vida, el estado nutricional o la tasa de VG21.
Conclusiones
Tanto la DF como la Gp constituyen los dos trastornos sensoriomotores gástricos que se presentan con mayor frecuencia en la práctica clínica, y su diagnóstico y tratamiento representan un reto. Por definición, parecieran ser afecciones diferentes, pero a lo largo de esta revisión hemos visto cómo comparten síntomas, etiología, mecanismos fisiopatológicos y tratamientos que se sobreponen. Lacy et al.27 proponen definir estos pacientes como DF con o sin retraso del VG (Fig. 2). Es por esto que el GpCRC considera que estas patologías forman parte de un mismo espectro de disfunción gastroduodenal sensoriomotora, en el que en el extremo más leve se encuentra la DF y en el extremo más grave está la Gp refractaria.
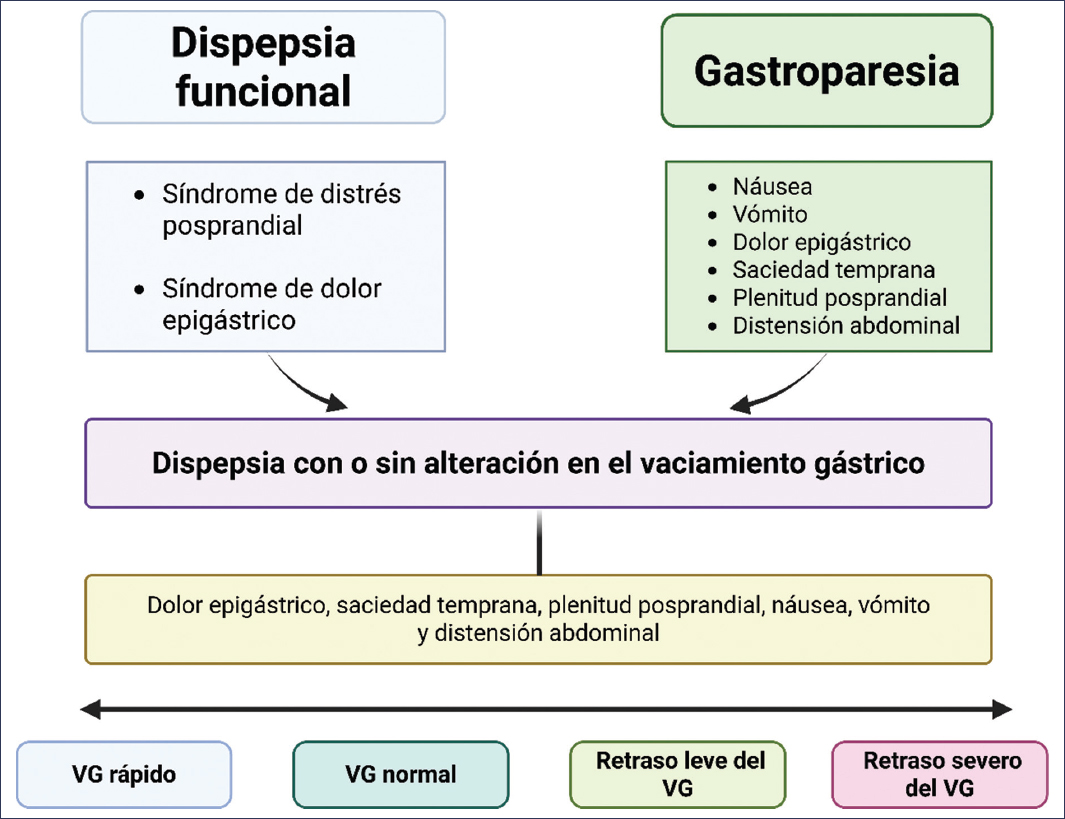
Figura 2. Espectro de los trastornos sensoriomotores gastroduodenales. VG: vaciamiento gástrico.
Financiamiento
Los autores declaran no haber recibido financiamiento para este estudio.
Conflicto de intereses
Los autores declaran no tener conflicto de intereses.
Consideraciones éticas
Protección de personas y animales. Los autores declaran que para esta investigación no se han realizado experimentos en seres humanos ni en animales.
Confidencialidad, consentimiento informado y aprobación ética. El estudio no involucra datos personales de pacientes ni requiere aprobación ética. No se aplican las guías SAGER.
Declaración sobre el uso de inteligencia artificial. Los autores declaran que no utilizaron ningún tipo de inteligencia artificial generativa para la redacción de este manuscrito.
