Introducción
Los trastornos de la conducta alimentaria (TCA) constituyen un grupo de trastornos crónicos caracterizados por patrones de alimentación que afectan negativamente la salud biopsicosocial de los pacientes, con un alto potencial de discapacidad y riesgo de mortalidad1,2. Los TCA comparten mecanismos fisiopatológicos con los trastornos de la interacción intestino-cerebro (TIIC), como la alteración en el procesamiento central y unos patrones de actividad anormal en regiones cerebrales específicas3,4. Estos trastornos suelen presentarse de manera superpuesta, y uno de los TIIC con mayor asociación a los TCA es la dispepsia funcional (DF)5,6. La identificación de este síndrome de superposición representa un desafío diagnóstico y terapéutico, ya que muchas de las manifestaciones de los TCA pueden confundirse con la sintomatología de la DF, especialmente con el espectro del síndrome de distrés posprandial (SDP). A su vez, los síntomas de la DF pueden actuar como causa o factor desencadenante de algunos TCA2,7–9. La asociación clínica y fisiopatológica entre la DF y los TCA depende del subtipo de TCA, que en la actualidad incluyen seis subtipos según la 5.a edición del Manual diagnóstico y estadístico de los trastornos mentales (DSM-5)10,11 (Tabla 1).
Tabla 1. Comparación de las principales características clínicas, epidemiológicas y de diagnóstico entre los tres fenotipos de trastorno de evitación/restricción de la ingesta de alimentos, síndrome de distrés posprandial con saciedad temprana, anorexia nerviosa, bulimia nerviosa y cibofobia
| Trastorno – fenotipo | Características | Síntomas o hallazgos | Grupo de afección | Asociación con pérdida de peso | Criterios diagnósticos |
|---|---|---|---|---|---|
| ARFID – fenotipo 1 (selectivo) | Ingesta limitada a ciertos tipos de alimentos (p. ej., textura, olor) | Baja ingesta por limitación sensorial | Niños, TEA | Sí | DSM-5: ARFID |
| ARFID – fenotipo 2 (ingesta limitada) | Falta de interés o hambre | Baja ingesta en todas las comidas, sin discriminación | Niños, TEA | Sí | DSM-5: ARFID |
| ARFID – fenotipo 3 (aversivo) | Miedo a consecuencias físicas al comer | Evitación por ansiedad o síntomas posprandiales | TIIC, patología digestiva | Sí | DSM-5: ARFID |
| Síndrome de distrés posprandial | Saciedad precoz y malestar posprandial | Llenado rápido, plenitud persistente | Mujeres, dispepsia funcional | Sí | Roma IV |
| Anorexia nerviosa | Restricción grave con preocupación por el peso | Pérdida de peso, distorsión de imagen corporal | Mujeres jóvenes | Sí | DSM-5: anorexia |
| Bulimia nerviosa | Atracones y conductas compensatorias | Episodios con culpa o vergüenza | Mujeres jóvenes | Variable | DSM-5: bulimia |
| Cibofobia | Miedo irracional a ciertos alimentos o a comer | Ansiedad extrema ante la comida | TEA, trastornos psiquiátricos | No, por lo general | No es diagnóstico formal (puede estar en ansiedad o fobia específica) |
|
ARFID: trastorno de evitación/restricción de la ingesta de alimentos; TEA: trastornos del espectro autista; TIIC: trastornos de la interacción intestino-cerebro. |
|||||
Prevalencia de dispepsia funcional en los pacientes con anorexia nerviosa, bulimia nerviosa y trastorno por atracón
La sintomatología gastrointestinal en los pacientes con TCA es frecuente, con una prevalencia reportada del 72%. Dentro de esta, los síntomas dispépticos del espectro del SDP son los más comunes, destacando la plenitud posprandial y la saciedad precoz, con prevalencias del 47% y el 39%, respectivamente. El dolor epigástrico es menos frecuente, pero se presenta en un 27% de los casos12.
La prevalencia de DF varía según el tipo de TCA, alcanzando hasta un 83.3% en la bulimia nerviosa y un 90% en la anorexia nerviosa13. En otros trastornos, como el trastorno de evitación/restricción de la ingesta de alimentos (ARFID, avoidant/restrictive food intake disorder), el trastorno por atracón y el síndrome de rumiación, la prevalencia es menor, con valores del 66.7%, el 53.6% y el 18.9%, respectivamente7,14,15 (Tabla 1). En cuanto a la pica, no se ha descrito una prevalencia específica de DF, y la relación entre ambas es difícil de establecer debido a la asociación de la pica con la anemia ferropénica, una complicación frecuente de diversas patologías gastrointestinales, como la gastropatía erosiva, la gastritis atrófica, la infección por Helicobacter pylori, la úlcera péptica y las enteropatías, las cuales pueden manifestarse con síntomas dispépticos16.
Relación bidireccional entre trastornos de la conducta alimentaria y dispepsia funcional
Los TCA comparten mecanismos fisiopatológicos establecidos en la DF, como son patrones de actividad anormal en regiones cerebrales específicas, retraso del vaciamiento gástrico y alteraciones de la acomodación fúndica3,4,14,17 (Fig. 1). De igual manera, también comparten mecanismos fisiopatológicos propuestos en la DF, como inflamación duodenal de bajo grado, disbiosis y alteraciones en la interacción grelina-leptina9,18–25 (Fig. 2). Al compartir mecanismos fisiopatológicos, esto podría explicar la asociación y la alta prevalencia de DF y ciertos TCA; sin embargo, también podría explicarse por un contexto clínico en el que los síntomas de DF pudieran ser secundarios a los TCA, o confundirse con síntomas primarios de dichos trastornos (p. ej., plenitud posprandial secundaria a episodios de atracón o confusión de ARFID con saciedad temprana)7,14.
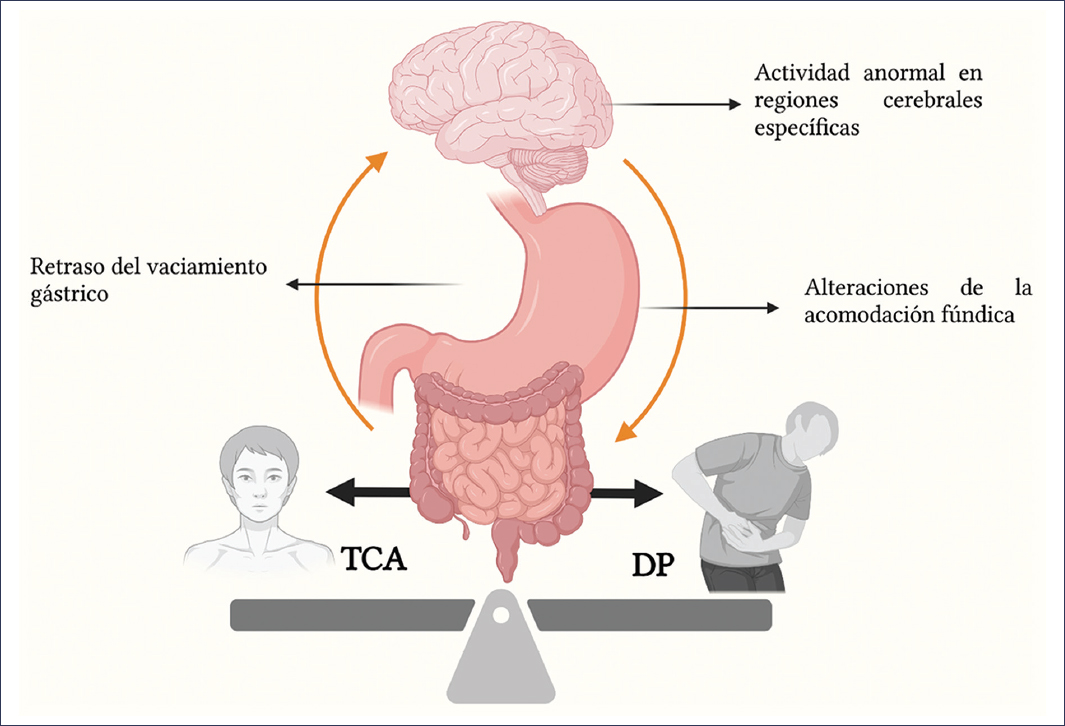
Figura 1. Mecanismos compartidos en la fisiopatología de los trastornos de la conducta alimentaria (TCA) y de la dispepsia funcional (DP) (creada con BioRender, 2025).
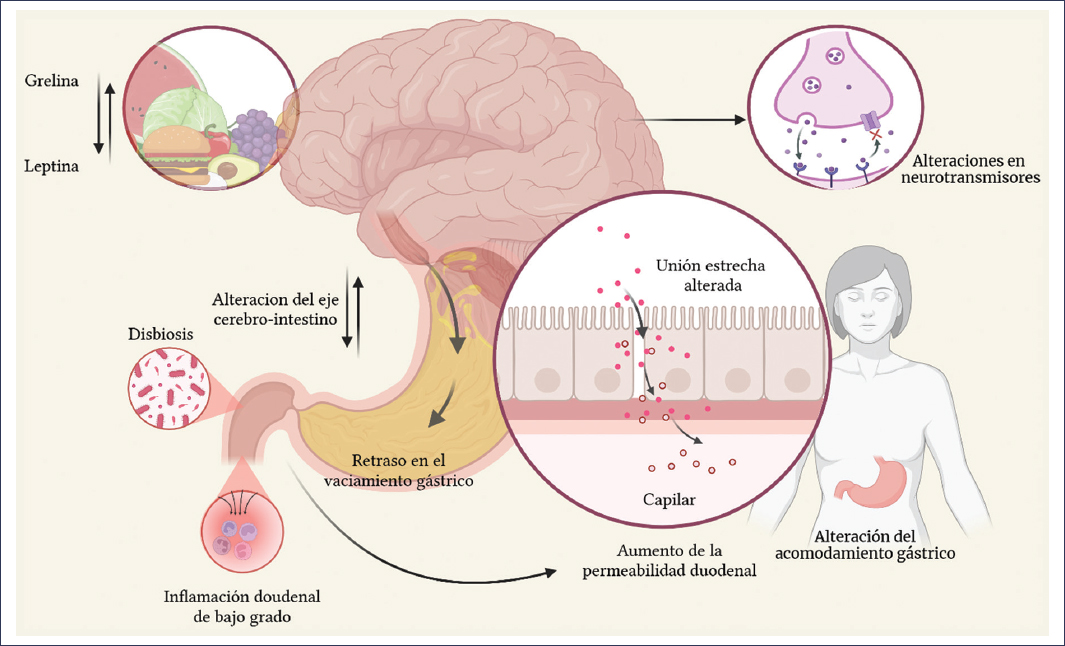
Figura 2. Mecanismos fisiopatológicos propuestos en la dispepsia funcional, incluyendo alteraciones en sitios neuroanatómicos específicos, irregularidades en neurotransmisores, incremento en la sensibilidad intestinal, alteración en la acomodación fúndica, inflamación duodenal de bajo grado (que condiciona un incremento de la permeabilidad duodenal) y disbiosis (creada con BioRender, 2025).
Factores de riesgo
La ansiedad se considera un factor de riesgo independiente para la DF y los TCA. En un estudio de cohorte realizado por Aro et al.26 se reportó que la ansiedad es un factor de riesgo independiente para desarrollar DF en un seguimiento de 10 años (odds ratio [OR]: 7.61; intervalo de confianza [IC] 99%: 1.21-47.73), en particular en pacientes con SDP (OR: 4.83; IC 99%: 1.24-18.76)26. Al igual que la ansiedad, pero menos, la depresión es un factor asociado a DF, reportándose una prevalencia del 20.9% en pacientes con DF y del 63.3% en aquellos con DF refractaria27.
El trastorno de ansiedad y la depresión también son factores de riesgo independientes para el desarrollo de TCA. Esto fue demostrado por Trompeter et al.28 en un metaanálisis de estudios prospectivos, en el que se identificó una asociación longitudinal entre la ansiedad y los TCA (OR: 1.58; IC 95%: 1.21-2.07, p = 0.002). Asimismo, se ha evidenciado una relación entre el trastorno depresivo y los TCA (OR: 1.82; IC 95%: 1.60-2.08; p < 0.0001)28,29.
La disbiosis parece ser un factor de riesgo independiente para el desarrollo de DF, como se ha propuesto en la DF posinfecciosa, y se plantea como un posible mecanismo en los TCA20,22,30. En pacientes con DF se ha encontrado un aumento en la abundancia del Phylum Fusobacteria y de los géneros Alloprevotella, Corynebacterium, Peptostreptococcus, Staphylococcus, Clostridium y Streptococcus, así como una disminución de los géneros Actinomyces, Gemella, Haemophilus, Megasphaera, Mogibacterium y Selenomonas31. Además de estos hallazgos, se ha identificado una correlación sintomática negativa entre la abundancia de Streptococcus y Prevotella con la sintomatología de DF, y también se ha descrito una respuesta clínica a la rifaximina en grupos específicos de DF31,32.
Al igual que en la DF, pero con menor evidencia, se han encontrado alteraciones en la microbiota de la población con TCA, especialmente en el grupo con trastorno por atracón. En estos pacientes se ha observado una disminución de Akkermansia e Intestinimonas, así como un aumento en la densidad de Bifidobacterium, Roseburia y Anaerostipes33.
Presentación clínica de los trastornos de la conducta alimentaria: un enfoque en gastroenterología
La sintomatología de la DF y los TCA puede confundirse debido a una interpretación inadecuada por parte del médico o a una expresión imprecisa del paciente, dado el carácter subjetivo de los síntomas. El uso de pictogramas para ejemplificar de manera objetiva la sintomatología podría ser de utilidad en la práctica clínica, al aumentar el rendimiento diagnóstico de la DF y discriminar aquellos casos con sintomatología distinta34.
Entre los síntomas que pueden generar confusión se encuentran la saciedad temprana, que puede confundirse con cibofobia o con ingesta limitada en ARFID, así como el vómito asociado a DF, que puede confundirse con rumiación, bulimia nerviosa o anorexia nerviosa34–36.
En el abordaje clínico también debe considerarse que los síntomas dispépticos pueden ser secundarios a un TCA (p. ej., plenitud posprandial secundaria a trastorno por atracón)7. De igual manera, los TCA pueden desarrollarse como consecuencia de la sintomatología de la DF, como en el caso del fenotipo aversivo de ARFID secundario a dolor epigástrico, ardor epigástrico o plenitud posprandial2,36–39.
Herramientas diagnósticas
Las herramientas diagnósticas utilizadas en el abordaje de los TCA en los pacientes con DF se basan principalmente en cuestionarios, con excepción de la rumiación, en cuyo caso se recomienda la realización de una manometría esofágica de alta resolución con impedancia, aplicando una prueba de provocación con comida sólida y una valoración posprandial2,40],41. Los cuestionarios de detección de TCA en pacientes con DF deben aplicarse cuando se sospeche la presencia de estos trastornos, como en casos de vómito, cibofobia, sospecha clínica de rumiación o SDP refractario, especialmente si se presenta como saciedad temprana, con o sin pérdida de.2 (Fig. 3).
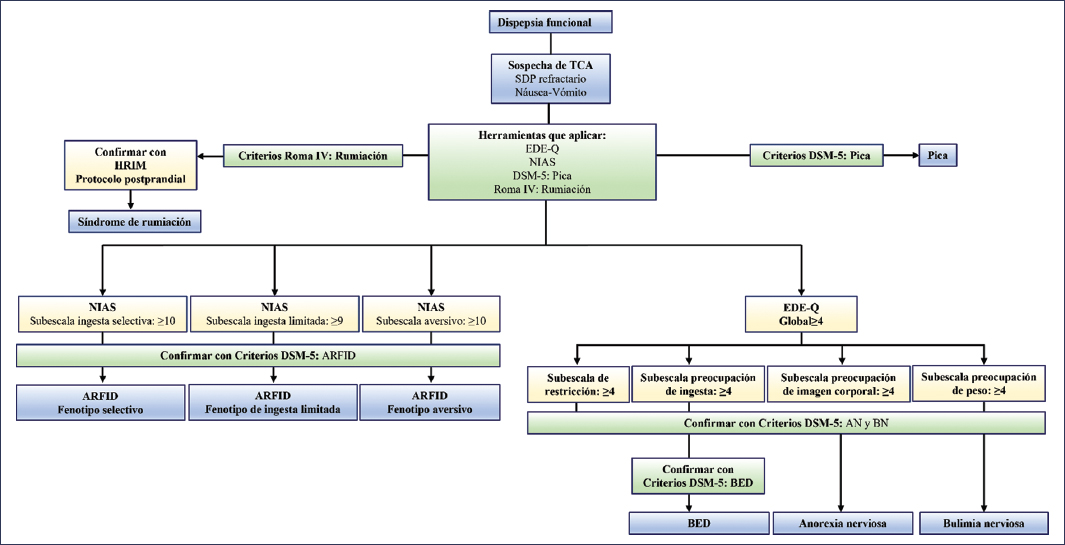
Figura 3. Herramientas diagnósticas utilizadas en el abordaje de los trastornos de la conducta alimentaria (TCA) en pacientes con dispepsia funcional. AN: anorexia nerviosa; ARFID: avoidant/restrictive food intake disorder (trastorno de evitación/restricción de la ingesta de alimentos); BED: binge eating disorder (trastorno por atracón); BN: bulimia nerviosa; DSM-5: Manual diagnóstico y estadístico de los trastornos mentales, 5.ª edición; EDE-Q: Eating Disorder Examination Questionnaire; HRIM: high resolution impedance manometry; NIAS: Nine Item Avoidant/Restrictive Food Intake Disorder Screen; SDP: síndrome de distrés posprandial.
Para el escrutinio de ARFID se debe utilizar el cuestionario Nine Item Avoidant/Restrictive Food Intake Disorder Screen (NIAS), para la rumiación los criterios de Roma IV, para la pica el DSM-5 y para el resto de los TCA el Eating Disorder Examination Questionnaire (EDE-Q)2. En caso de escrutinio positivo para TCA se procederá a la confirmación diagnóstica de ARFID, anorexia nerviosa, bulimia nerviosa o trastorno por atracón mediante los criterios del DSM-5Haz clic o pulse aquí para escribir texto.11 (Fig. 3).
Abordaje y manejo multidisciplinario
El abordaje y el manejo de un síndrome de superposición con TCA requiere una estructura holística conformada por neurogastroenterología, psiquiatría, psicología y nutrición clínica. Para determinar el rol de cada especialista del equipo multidisciplinario se deberá tener en cuenta el fenotipo de cinco dominios conformados por las características propias del TCA, el impacto en la salud física (TIIC, malnutrición, etc.), la comorbilidad psiquiátrica y la comorbilidad social (calidad de vida, impacto en las relaciones interpersonales, etc.). Por lo mencionado, en todo paciente con TCA se deberán aplicar las escalas GAD-7 (7-item Generalized Anxiety Disorder Scale), PHQ-9 (9-item Patient Health Questionnaire), CIA (clinical impairment assessment) y WHODAS-12 (12-item World Health Organization Disability Assessment Schedule). La valoración multidisciplinaria considerando estos cinco dominios se deberá realizar de manera basal y a los 3, 6, 12 y 24 meses2. El manejo por parte de neurogastroenterología se dirige sobre todo a la DF, y en caso de requerir neuromodulación, buscar la opción farmacológica con mejor perfil de seguridad y con efecto dual sobre los TCA, la comorbilidad psiquiátrica y la DF2,41 (Fig. 4). En la rumiación con DF se sugieren ejercicios de respiración diafragmática dirigidos por biorretroalimentación, en conjunto con amitriptilina en caso de síndrome de dolor epigástrico o con mirtazapina en el SDP2,42,43. En el ARFID con fenotipo selectivo o de ingesta limitada, el neuromodulador de elección es la mirtazapina, pero ante un fenotipo aversivo secundario a síndrome de dolor epigástrico deberá considerarse la amitriptilina. En el trastorno por atracón se deberá tener en cuenta el fenotipo de patrón de alimentación, atracones dependientes del estado de ánimo, ausencia de saciedad o alto requerimiento de consumo calórico para inducción de saciedad, valorado por el test de comida bufet ad libitum positiva44]. En los pacientes con anorexia nerviosa o bulimia nerviosa, se sugiere la referencia a psiquiatría, independientemente del fenotipo DF45,46 (Fig. 5).
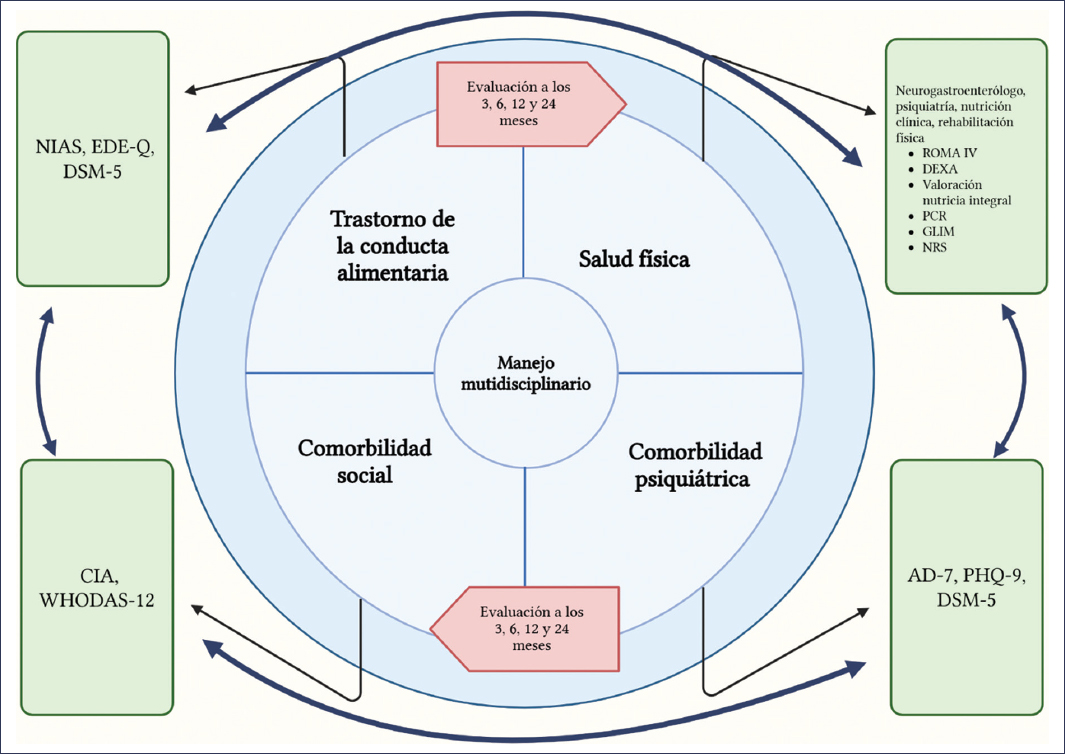
Figura 4. Cuatro dominios para el abordaje y el manejo multidisciplinario. AD-7: 7-item anxiety and depression scale; CIA: clinical impairment assessment; DEXA: absorciometría dual de rayos X; DSM-5: manual diagnóstico y estadístico de los trastornos mentales, 5.ª edición; EDE-Q: eating disorder examination questionnaire; GLIM: global leadership initiative on malnutrition; HRIM: high resolution impedance manometry (manometría esofágica de alta resolución con impedancia); NIAS: nine item avoidant/restrictive food intake disorder screen; NRS: nutritional risk screening; PCR: proteína C reactiva; PHQ-9: patient health questionnaire-9; WHODAS-12: 12-item world health organization disability assessment schedule.
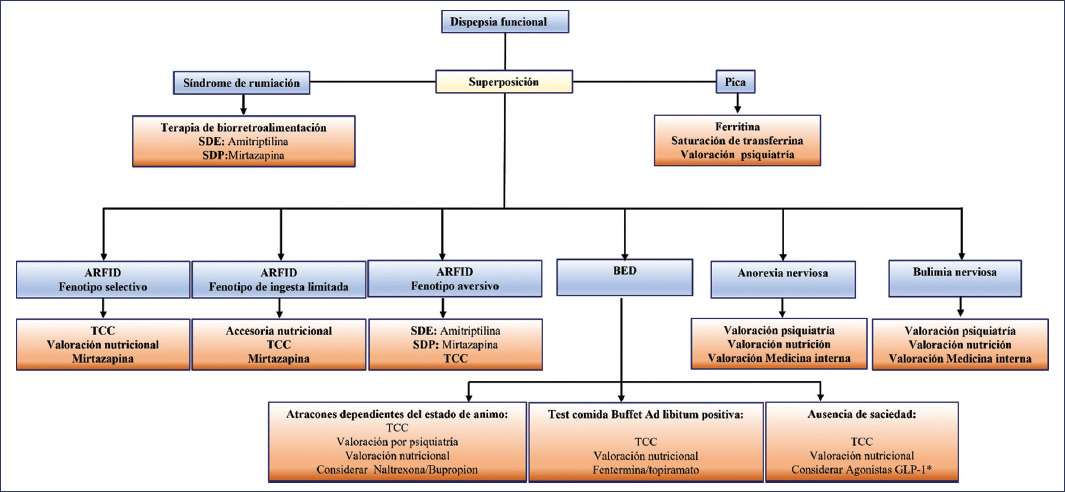
Figura 5. Estrategias de manejo, incluyendo valoración por especialistas y neuromodulador de elección. ARFID: avoidant/restrictive food intake disorder (trastorno de evitación/restricción de la ingesta de alimentos); BED: binge eating disorder (trastorno por atracón); SDE: síndrome de dolor epigástrico; SDP: síndrome de distrés posprandial; TTC: terapia cognitivo-conductual.
Detección temprana en adolescentes y adultos jóvenes
Ciertos TCA, como la anorexia nerviosa, suelen manifestarse en la adolescencia, con un patrón constante de inicio antes de los 14 años según numerosos estudios47,48. Se ha identificado que los TCA son más frecuentes en población con trastornos del espectro autista, por lo que se recomienda tomar una consideración especial en el escrutinio de este grupo de población48. La importancia de detectar de manera temprana los TCA es evitar complicaciones asociadas, como un aumento en el riesgo de suicidio, conductas autolesivas no suicidas, cleptomanía, abuso de sustancias y conductas sexuales de riesgo, así como complicaciones físicas con afección multiorgánica45,46.
Conclusiones
Dentro de la sintomatología gastrointestinal identificada en los pacientes con TCA, los síntomas del espectro de la dispepsia han sido los más frecuentemente reportados, con una prevalencia que varía según el tipo de TCA. En el caso de la bulimia nerviosa, estos síntomas pueden presentarse hasta en el 83.3% de los pacientes. Se ha establecido una relación fisiopatológica entre la DF y los TCA sustentada en mecanismos compartidos, como la alteración del procesamiento central, la dismotilidad gástrica y la inflamación de bajo grado. Esta superposición genera un síndrome clínico complejo, de difíciles diagnóstico y abordaje, ya que ambas afecciones comparten síntomas que pueden confundirse o solaparse, lo cual retrasa la implementación de intervenciones efectivas. Tal dificultad diagnóstica se ve agravada por factores relacionados con la comunicación y la interpretación precisa de los síntomas, lo que refuerza la necesidad de aplicar herramientas diagnósticas específicas. El diagnóstico y el manejo de estos síndromes de superposición deben abordarse de manera multidisciplinaria, con la participación de especialistas en salud física y salud mental, evaluando el entorno psicosocial y ajustando la intervención a la comorbilidad identificada en cada paciente. Asimismo, el seguimiento periódico y el diagnóstico oportuno son fundamentales para prevenir complicaciones asociadas y optimizar los desenlaces clínicos.
Financiamiento
Los autores declaran no haber recibido financiamiento para este estudio.
Conflicto de intereses
Los autores declaran no tener conflicto de intereses.
Consideraciones éticas
Protección de personas y animales. Los autores declaran que para esta investigación no se han realizado experimentos en seres humanos ni en animales.
Confidencialidad, consentimiento informado y aprobación ética. El estudio no involucra datos personales de pacientes ni requiere aprobación ética. No se aplican las guías SAGER.
Declaración sobre el uso de inteligencia artificial. Los autores declaran que no utilizaron ningún tipo de inteligencia artificial generativa para la redacción de este manuscrito.
