Introducción
La dispepsia funcional (DF) es uno de los trastornos más frecuentes de la interacción intestino-cerebro, caracterizado por síntomas persistentes como plenitud posprandial, saciedad precoz, dolor epigástrico y ardor, en ausencia de lesiones estructurales demostrables. Más allá de su alta prevalencia, la DF representa un reto clínico debido a su curso crónico, su impacto negativo en la calidad de vida y su compleja fisiopatología, en la que convergen alteraciones motoras, sensitivas, inmunitarias y psicológicas.
La creciente evidencia sobre la bidireccionalidad del eje intestino-cerebro ha resaltado el papel de factores psicosociales, como el estrés crónico, la ansiedad, la depresión y los trastornos somatomorfos, en la génesis y la perpetuación de la DF. A su vez, la DF puede ser un factor predisponente o amplificador de síntomas afectivos, consolidando un ciclo clínico difícil de romper. Ante esta complejidad, han surgido nuevas estrategias terapéuticas, entre ellas las intervenciones psicológicas estructuradas y la modulación del eje intestino-cerebro mediante psicobióticos.
Asociación de dispepsia funcional con ansiedad, depresión y trastornos somatomorfos
Globalmente, se estima que entre el 30% y el 60% de los pacientes con DF presentan comorbilidad con ansiedad o depresión1,2, y hasta el 50% con trastornos somatomorfos, como el trastorno de somatización3.
En Suecia, un estudio poblacional reportó una prevalencia de DF del 15.6% al inicio y del 13.3% a los 10 años seguimiento. La ansiedad se asoció con DF (razón de momios [RM]: 6.30; intervalo de confianza [IC] 99%: 1.64-24.16) y con el subtipo de malestar posprandial tanto al inicio (RM: 4.83; IC 99%: 1.24-18.76) como en el seguimiento (RM: 8.12; IC 99%: 2.13-30.85). La presencia de ansiedad al inicio del estudio se asoció con la aparición de nuevos casos de DF en el seguimiento (RM: 7.61; IC 99%: 1.21-47.73)4. En Latinoamérica, los estudios epidemiológicos son limitados, pero se ha reportado una alta prevalencia de síntomas ansiosos y depresivos en pacientes con trastornos funcionales digestivos.
Históricamente, la gastroparesia y la DF se han clasificado como trastornos gastrointestinales distintos, diferenciados por la presencia o ausencia de vaciamiento gástrico retardado, respectivamente. En una revisión sistemática con metaanálisis, la prevalencia global de ansiedad fue similar (p = 0.12) en pacientes con gastroparesia (49%) y DF (29%), así como la prevalencia de depresión en pacientes con gastroparesia (39%) y DF (32%) (p = 0.37). La relación entre ansiedad (r = 0.30) y depresión (r = 0.32) se observó únicamente en los pacientes con DF5.
Los pacientes con DF pueden manifestar alteraciones en la acomodación y el vaciamiento gástrico, además de hipersensibilidad visceral. En un estudio de 259 pacientes consecutivos con DF según los criterios de Roma II sometidos a baróstato gástrico, prueba de aliento y cuestionarios psiquiátricos (entre ellos el Inventario de Ansiedad Estado-Riesgo), aquellos con un trastorno de ansiedad comórbido presentaron aumentos iniciales significativamente más lentos en el volumen gástrico, alcanzaron un máximo más bajo y mostraron un retorno más lento al nivel basal, en comparación con los pacientes sin trastorno de ansiedad6.
El trastorno de somatización, también conocido como trastorno de síntomas somáticos, se define como la presencia de múltiples síntomas físicos persistentes que no pueden explicarse completamente por una condición médica general, y que están asociados con pensamientos, sentimientos y comportamientos excesivos relacionados con esos síntomas, causando un malestar significativo y afectando de manera negativa la vida7.
La somatización, entendida como la tendencia a experimentar y comunicar el malestar psicológico a través de síntomas físicos, también contribuye significativamente a la carga sintomática en la DF, mediando a menudo los efectos de la depresión sobre la gravedad de los síntomas1.
La somatización actúa con frecuencia como un puente psicopatológico entre ansiedad/depresión y DF. Se ha encontrado que los síntomas somáticos mediatizan la relación bidireccional entre los síntomas afectivos y la disfunción funcional, contribuyendo a la cronificación y la demanda excesiva de atención médica8.
Los síntomas somáticos no son solo subproductos inocentes de la ansiedad y la depresión; son verdaderos «centros de control» que pueden amplificar y mantener el malestar emocional a través de la mediación (Tabla 1).
Tabla 1. ¿Por qué ocurre la mediación en la somatización?
| Paso | Mecanismo propuesto | Descripción del mecanismo | Indicador práctico |
|---|---|---|---|
| 1 | Hiperexcitación (locus coeruleus) | Tormenta autonómica con sensaciones cardiorrespiratorias | Palpitaciones, falta de aire, BAI/PHQ-15 |
| 2 | Inferencia interoceptiva negativa | Interpretación predictiva catastrófica con rumiación pesimista (cognición depresiva) | Ansiedad por la salud, catastrofización, B-IPQ |
| 3 | Supresión/retraimiento conductual | Mantiene los desencadenantes de ansiedad sin probar (sin desconfirmación) | Anergia en PHQ-9; menor actividad física (pasos) |
| 4 | Ciclo vicioso | Malestar corporal con interpretación como amenaza y angustia corporal | Uso creciente del sistema de salud con múltiples consultas. |
|
B-IPQ: brief illness perception questionnaire; BAI: beck anxiety inventory; PHQ: Patient Health Questionnaire. |
|||
El enfoque biopsicosocial integrado es clave en la atención de los pacientes con DF y comorbilidad psiquiátrica. La Asociación Mexicana de Gastroenterología y la Asociación Mexicana de Neurogastroenterología y Motilidad proponen las siguientes recomendaciones de buena práctica clínica9:
- – Manejar en conjunto con psiquiatría a los pacientes con trastornos de la interacción cerebro-intestino y comorbilidad psiquiátrica, cuando se requiera la combinación de neuromoduladores o psicoterapia.
- – Tamizar para depresión y ansiedad en todo paciente con trastornos de la interacción cerebro-intestino, utilizando escalas autoaplicables (Hospital Anxiety and Depression Scale [HADS], Patient Health Questionnaire-9 [PHQ-9] o Generalized Anxiety Disorder 7-item [GAD-7).
- – Interconsultar con salud mental (psiquiatría o psicología) en pacientes con trastornos de la interacción cerebro-intestino que presenten depresión o ansiedad moderada a grave, uso de neuromoduladores a dosis con acción central o trastorno de la conducta alimentaria.
- – Manejo multidisciplinario de los trastornos de la interacción cerebro-intestino asociados a trastornos afectivos y somáticos.
- – Adoptar un enfoque más integral, centrado en el paciente, considerando tanto los síntomas físicos como los aspectos psicológicos y del comportamiento, y detectar predictores de gravedad como alexitimia, somatización persistente y desmoralización.
- – Utilizar herramientas de evaluación validadas y accesibles (PHQ-15 y Symptom Checklist-90 [SCL-90]) en pacientes con trastornos de síntomas somáticos.
Papel del estrés y de la hipersensibilidad central
La evidencia acumulada en modelos animales, estudios de neuroimagen funcional y cohortes clínicas apunta hacia una interacción compleja del eje hipotálamo-hipófisis-adrenal, la respuesta autonómica, la inflamación neurogénica y la disfunción sensoriomotora del tracto digestivo superior.
Los mecanismos fisiopatológicos subyacentes a la DF, la ansiedad, la depresión y los trastornos somatomorfos son complejos y multidireccionales (Fig. 1). El estrés y la hipersensibilidad central desempeñan roles significativos en la fisiopatología de la DF, especialmente al considerar la influencia de la ansiedad, la somatización y otros factores psicológicos en la gravedad de los síntomas. Se sabe que el estrés crónico agrava los síntomas de la DF al inducir hipersensibilidad en las aferencias vagales gástricas, que son fundamentales para detectar la estimulación mecánica relacionada con la ingesta y modular la función gastrointestinal10.

Figura 1. Mecanismos fisiopatológicos bidireccionales. La desregulación del eje hipotálamo-hipófisis-adrenal conduce a una respuesta alterada al estrés. La disfunción autonómica y el procesamiento afectivo alterado ocurren principalmente en la ínsula y el cíngulo. La hipersensibilidad visceral está mediada por mecanismos centrales y periféricos. La motilidad gástrica se caracteriza por vaciamiento retardado y alteración en la acomodación fúndica. Los rasgos psicológicos más frecuentes son alexitimia, neuroticismo y estilos de afrontamiento disfuncionales. La activación inmunitaria por eosinófilos y mastocitos en la mucosa duodenal se correlaciona con los síntomas. La disfunción de la barrera intestinal aumenta la permeabilidad intestinal por reducción de la zonulina-1. La disbiosis intestinal duodenal se asocia a síntomas posprandiales1,3,6,8,11,30.
El estrés psicosocial, en particular cuando es crónico o asociado a experiencias adversas tempranas, actúa como un factor predisponente, desencadenante y perpetuante de la DF. Los estudios poblacionales han mostrado que los pacientes con DF presentan una mayor frecuencia de eventos estresantes previos al inicio de los síntomas y una mayor prevalencia de trastornos afectivos como ansiedad y depresión, lo cual refuerza la bidireccionalidad de la relación intestino-cerebro1.
La hipersensibilidad central, una respuesta aumentada del sistema nervioso central a estímulos sensoriales normales, está influenciada por factores psicológicos como la ansiedad y la somatización. En particular, la ansiedad se ha asociado con una mayor sensibilidad gástrica y mayor gravedad de los síntomas1,11.
Los modelos en roedores han demostrado que el estrés crónico leve e impredecible induce conductas de tipo ansioso y depresivo, pérdida de peso y disminución de la ingesta alimentaria. Estos cambios se acompañan de una hipersensibilidad de las aferencias vagales gástricas encargadas de transmitir información mecánica al encéfalo, lo que se traduce en una mayor percepción de distensión y plenitud10.
Los factores psicosociales, incluyendo el estrés percibido, y los trastornos psiquiátricos pueden alterar la señalización intestino-cerebro, lo que conduce a trastornos de la motilidad y a hipersensibilidad visceral. La interacción del estrés y la hipersensibilidad central se ve respaldada por evidencia que muestra que el estrés puede modular la expresión de citocinas inflamatorias y neuropéptidos, como el factor liberador de corticotropina, los cuales están implicados en la hiperalgesia gástrica inducida por el estrés12.
La hipersensibilidad visceral es uno de los mecanismos más frecuentemente documentados en los pacientes con DF. Se estima que entre el 34% y el 66% tienen una percepción aumentada de la distensión gástrica, lo cual se asocia con dolor posprandial, saciedad precoz y náuseas1,10. Esta hipersensibilidad puede ser consecuencia tanto de sensibilización periférica (aferencias vagales y espinales) como de facilitación central. A nivel central, los estudios de resonancia magnética funcional han demostrado una activación aumentada en regiones como la ínsula, el tálamo y el cíngulo anterior en respuesta a la distensión gástrica, lo cual sugiere una disfunción en el procesamiento interoceptivo y en los circuitos de modulación del dolor1. Adicionalmente, se ha implicado la reducción de la conectividad funcional descendente en la falta de inhibición del dolor visceral.
Terapias psicológicas en la dispepsia funcional
La fisiopatología multifactorial de la DF y la limitada eficacia de los tratamientos farmacológicos han motivado el desarrollo de estrategias complementarias centradas en la modulación de la percepción visceral y los procesos cognitivo-afectivos. Las terapias psicológicas han demostrado ser eficaces en el tratamiento de la DF, en especial en contextos de ansiedad, depresión o trastornos somatomorfos asociados. Estas terapias son parte integral del enfoque biopsicosocial recomendado para el manejo de la DF, el cual enfatiza la atención a los componentes tanto psicológicos como fisiológicos del trastorno, y deben considerarse desde etapas tempranas del tratamiento y no como una opción final.
Terapia cognitivo-conductual
La terapia cognitivo-conductual (TCC) es la intervención psicológica con mayor respaldo empírico en el tratamiento de los trastornos funcionales digestivos. Se basa en identificar y modificar patrones de pensamiento disfuncionales, creencias irracionales y conductas de evitación que amplifican los síntomas (Fig. 2).
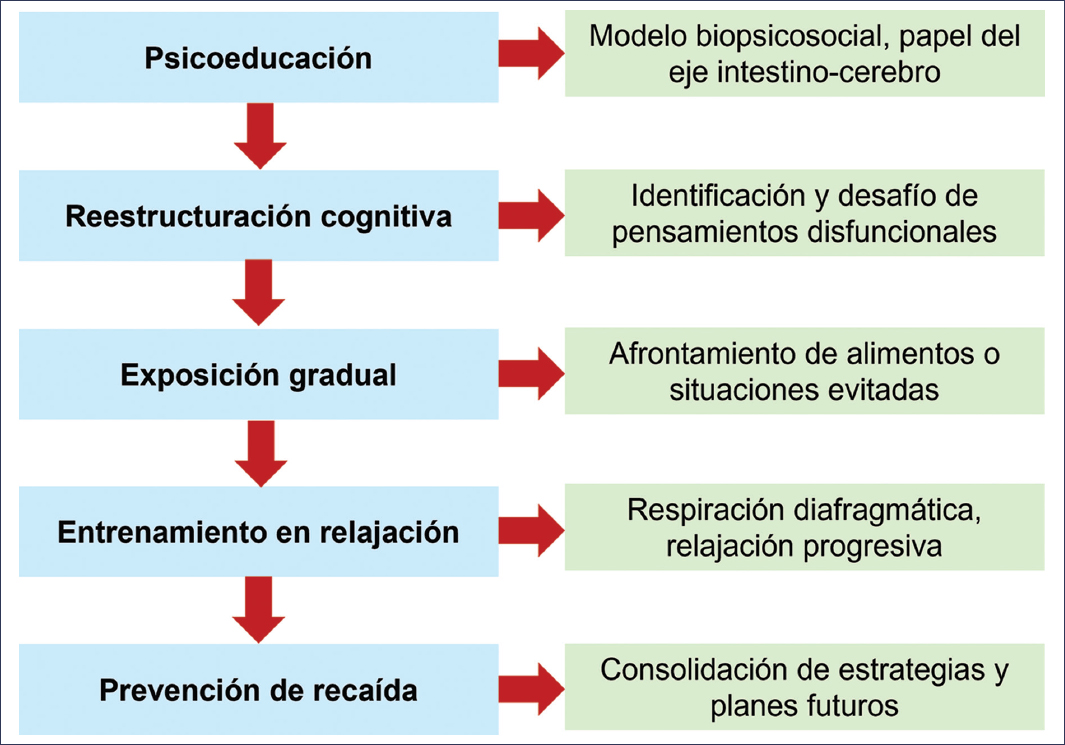
Figura 2. Componentes típicos de un protocolo de terapia cognitivo-conductual para dispepsia funcional15.
Un estudio clínico (n = 49) aleatorizó a 24 participantes al método del tema central de relación conflictiva y 25 a tratamiento médico estándar, y a 12 meses de seguimiento se observó una mejoría significativa en todos los síntomas de DF (pirosis/regurgitación, náusea/vómito, saciedad, llenura y dolor abdominal)13.
Un metaanálisis de 14 estudios aleatorizados (n = 1434) evidenció que las intervenciones psicológicas, especialmente la TCC, mejoran significativamente los síntomas dispépticos (diferencia de medias estandarizada [SMD]: −1.06) y reducen la ansiedad (SMD: −0.80) y la depresión (SMD: −1.11), con efectos sostenidos hasta por 12 meses14. La TCC individual o grupal mejora la calidad de vida, disminuye la frecuencia y la intensidad de los síntomas, y optimiza la funcionalidad psicosocial15. La TCC breve o de corta duración no ha mostrado diferencias significativas frente a controles activos, lo que resalta la importancia del formato y la duración de la intervención.
A pesar de los datos limitados, la evidencia disponible sugiere que la terapia psicológica es beneficiosa en el tratamiento de los pacientes con DF, y debería ser considerada por los médicos tratantes si está disponible y los pacientes están dispuestos.
Hipnoterapia
La hipnoterapia ericksoniana, desarrollada por Milton H. Erickson, se caracteriza por el uso de técnicas como la distracción, el particionamiento, la progresión, la sugestión, la reorientación y la utilización. Estas estrategias promueven una terapia centrada en soluciones y empoderan al paciente, facilitando cambios cognitivos y conductuales. Aunque la evidencia científica sobre su eficacia aún es limitada y en ocasiones cuestionada, algunos estudios sugieren que puede contribuir a la reestructuración cognitiva y a la disminución de síntomas en ciertos trastornos. Por ejemplo, se ha utilizado en el tratamiento de trastornos de la conducta alimentaria, de fobias y de conductas obsesivas16. En la práctica clínica, se realizan un total de 13 sesiones de 45-50 minutos enfocadas en objetivos claros y puntuales definidos por el paciente17.
La hipnoterapia centrada en el eje intestino-cerebro utiliza sugestiones guiadas y visualización para modular la percepción visceral y reducir la ansiedad anticipatoria. Se ha propuesto que 12 sesiones semanales de hipnoterapia mejoran significativamente los síntomas dispépticos y el malestar emocional, con beneficios mantenidos a 12 meses18.
La hipnoterapia ha sido particularmente eficaz en pacientes con DF tipo dolor epigástrico y con perfil de hipersensibilidad visceral. Su aplicación está respaldada por guías clínicas y se recomienda como parte de las terapias cerebro-intestino para el dolor crónico refractario15. Sus limitaciones incluyen disponibilidad limitada de terapeutas entrenados, estigmas culturales y falta de estandarización del protocolo, aunque los formatos grupales o virtuales han mostrado ser prometedores.
Mindfulness
Las terapias basadas en la atención plena, como la técnica de mindfulness, integran principios de TCC con prácticas meditativas orientadas a la aceptación de la experiencia interna sin juicio, y también han mostrado ser prometedoras en el manejo de la DF. Como técnica, el mindfulness permite la regulación emocional, la relajación y la desensibilización progresiva hacia los estímulos detonadores19.
Un ensayo piloto aleatorizado de 8 semanas (n = 28) reportó una mejoría del 90% de los síntomas en el grupo de mindfulness, frente al 45% en el grupo de tratamiento estándar (p= 0.063)20. En un estudio aleatorizado (n = 80), los pacientes del grupo de mindfulness reportaron a 8 semanas menores puntajes de síntomas gastrointestinales y mejor calidad de vida en comparación con el grupo de tratamiento estándar (p < 0.05)21. En ambos estudios, la aceptabilidad y la adherencia fueron buenas, y se utilizaron en entornos con alta rotación de pacientes.
Los enfoques de mindfulness ayudan a disminuir la hipersensibilidad visceral y a mejorar la evaluación cognitiva de los síntomas, lo que contribuye a una mejor calidad de vida.
Modulación del eje intestino-cerebro con psicobióticos
Cada vez hay más evidencia, especialmente proveniente de investigaciones en animales, que indica que el microbioma intestinal influye de manera significativa en el funcionamiento del cerebro.
En humanos, los estudios han revelado vínculos entre la composición y la actividad del microbioma con trastornos emocionales y del comportamiento, además de mostrar correlaciones con ciertos patrones observados en estudios de neuroimagen cerebral. Se ha identificado disbiosis en pacientes con DF, caracterizada por un aumento de Streptococcus en la cavidad oral, el estómago y el duodeno22.
Los probióticos son microorganismos vivos que, cuando se administran en cantidades adecuadas, confieren un beneficio para la salud del huésped23. Los psicobióticos son un subgrupo de probióticos específicos con propiedades conductuales y cognitivas en el eje cerebro-intestino, capaces de modular los niveles de neurotransmisores, reducir la inflamación y mejorar la función de la barrera intestinal24,25.
Lactobacillus plantarum fortalece la barrera intestinal mediante la producción de polisacáridos capsulares que refuerzan las uniones estrechas entre enterocitos (como ZO-1) y ocludina. Además, la cepa L. plantarum PS128 ha demostrado propiedades psicotrópicas en modelos animales y se ha observado que disminuye los niveles de cortisol y aumenta la concentración de neurotransmisores, como la dopamina y la serotonina, en regiones cerebrales clave como son la corteza prefrontal y el cuerpo estriado26,27.
Se ha demostrado una disminución en la producción de citocinas proinflamatorias, como el factor de necrosis tumoral alfa y las interleucinas 6 y 1b, al mismo tiempo que aumentan los niveles de citocinas antiinflamatorias, como la interleucina 10. También modulan factores neurotróficos, como el factor neurotrófico derivado del cerebro y el factor neurotrófico derivado de la glía, los cuales están implicados en la plasticidad neuronal y la respuesta al estrés22.
El uso de Bifidobacterium animalis subsp. lactis BL-99 ha demostrado mejorar significativamente los síntomas de DF, incluyendo la plenitud posprandial, la saciedad precoz y el dolor epigástrico, con efectos dependientes de la dosis28. También se observaron cambios positivos en la microbiota intestinal, con aumento de Faecalibacterium prausnitzii y Bacteroides ovatus, bacterias asociadas con la producción de ácidos grasos de cadena corta beneficiosos para la integridad de la mucosa intestinal.
El uso de psicobióticos en la DF es prometedor, ya que pueden aliviar los síntomas tanto gastrointestinales como psicológicos al remodelar el eje microbiota-intestino-cerebro (Tabla 2).
Tabla 2. Psicobióticos con evidencia experimental o clínica relevante22,26–29
| Cepa | Efectos observados |
|---|---|
| Bifidobacterium longum 1714 | Reducción de reactividad al estrés |
| Lactobacillus plantarum PS128 | Aumentan dopamina y serotonina, disminuyen ansiedad y depresión |
| Bifidobacterium animalis subsp. lactis BL-99 | Disminuyen síntomas dispépticos, modulación gastrointestinal |
| Fructooligosacáridos/galactooligosacáridos (prebióticos) | Aumenta factor neurotrófico derivado del cerebro, disminuye inflamación, mejora de ánimo |
Conclusiones
La comprensión actual de la DF ha evolucionado hacia un modelo integrador que reconoce la participación de factores psicológicos, inmunoneuroendocrinos y microbianos. Mecanismos como la hipersensibilidad visceral, la disfunción del eje hipotálamo-hipófisis-adrenal y la neuroinflamación explican por qué los síntomas como ansiedad, depresión y somatización son más que comorbilidad y actúan como amplificadores clínicos. Este entendimiento ha impulsado estrategias terapéuticas más amplias, incluyendo psicoterapias estructuradas (como la TCC, la hipnoterapia y el mindfulness), que han demostrado eficacia sostenida. En paralelo, la modulación del eje intestino-cerebro mediante psicobióticos, con cepas como L. plantarum PS128 y B. animalis BL-99, representa un enfoque emergente con potencial clínico dual sobre los síntomas digestivos y afectivos. El tratamiento de la DF debe orientarse a un modelo personalizado y multidisciplinario, incorporando intervenciones centradas en el paciente y apoyadas por la evidencia, que articulen herramientas psicoterapéuticas, neuromodulación y estrategias dirigidas al microbioma.
Financiamiento
El autor declara no haber recibido financiamiento para este estudio.
Conflicto de intereses
El autor declara no tener conflicto de intereses.
Consideraciones éticas
Protección de personas y animales. El autor declara que para esta investigación no se han realizado experimentos en seres humanos ni en animales.
Confidencialidad, consentimiento informado y aprobación ética. El estudio no involucra datos personales de pacientes ni requiere aprobación ética. No se aplican las guías SAGER.
Declaración sobre el uso de inteligencia artificial. El autor declara que utilizó inteligencia artificial (ChatGpt y Open Evidence) para la revisión de literatura, la redacción y la corrección de este artículo.
