Introducción al rol de la dieta en el síndrome de intestino irritable
Dado que un 70-89% de los pacientes con síndrome de intestino irritable (SII) reportan la exacerbación de sus síntomas con algunos alimentos específicos, es común que ellos mismos suelan retirarlos de su dieta, impactando de manera negativa sobre el estado nutricio1. Por ende, la dieta es un pilar fundamental en el manejo del SII. Como tratamiento de primera línea se recomienda la implementación de cambios dietéticos y del estilo de vida de las guías del National Institute for Health and Care Excellence (NICE), que se muestran en la tabla 1, y como tratamiento de segunda línea una dieta restrictiva, como es la dieta baja en oligosacáridos, disacáridos, monosacáridos y polioles fermentables (FODMAP, Fermentable Oligosaccharide, Disaccharide, Monosaccharide and Polyols)2. Esta intervención dietética representa el abordaje con mayor evidencia científica para tratar el SII, pero por su complejidad se siguen estudiando diferentes estrategias nutricionales con la finalidad de encontrar una que facilite el apego por parte de los pacientes. Abordajes dietéticos menos restrictivos, sin disrupción de la microbiota ni del estado nutricional de micronutrientes, son las alternativas dietéticas que se estan proponiendo.
Tabla 1. Recomendaciones generales de las guías del National Institute for Health and Care Excellence (NICE)
| Realizar comidas regularmente |
| Evitar ayunos prolongados (> 4 horas) |
| No saltarse comidas |
| Tomar 8 vasos de agua al día |
| Limitar el consumo de cafeína a un máximo de 3 tazas al día |
| Limitar el consumo de fruta fresca a 3 porciones al día |
| Reducir el consumo de alimentos industrializados |
| Evitar edulcorantes artificiales (con la terminación –ol) |
Dieta baja en FODMAP: ¿la mejor estrategia?
Principios de la dieta y su efectividad clínica
La dieta baja en FODMAP es una intervención dietética que reduce la ingesta de oligosacáridos, disacáridos, monosacáridos y polioles fermentables con la finalidad de disminuir la presión osmótica y la fermentación bacteriana en el intestino. Actualmente es la intervención dietética con más respaldo científico para el manejo del SII.
Diversos metaánalisis han mostrado una mejora significativa en los síntomas globales con una dieta baja en FODMAP, en comparación con otras dietas tradicionales. Un metaanálisis reveló una razón de riesgo de 1.21 (intervalo de confianza del 95%: 0.98-1.51) para la mejoría global de síntomas con la dieta baja en FODMAP, en particular en dolor y distensión abdominal, aunque con una heterogeneidad significativa entre los estudios (I2 = 63%)3.
Proceso de eliminación y reintroducción
Este régimen alimenticio consta de tres fases4:
- Fase de eliminación: se restringen todos los FODMAP durante 4 a 8 semanas aproximadamente; la dieta se considera baja cuando el aporte es < 0.5 g por ingestión o < 3 g/día5. Las proporciones que debe cumplir esta eliminación se muestran en la tabla 26.
- Fase de reintroducción: se reintroduce progresivamente cada grupo de FODMAP, de forma no sumatoria para evitar efecto aditivo y lograr identificar la tolerancia individual de cada grupo de alimentos. Cuando se identifica un grupo o alimento específico que desencadene la sintomatología clásica, se suspenderá de nuevo y se valorará su eliminación definitiva5.
- Fase de personalización: en ella se pueden consumir alimentos con contenido de FODMAP de acuerdo con su tolerancia, controlando así los síntomas5 (Tabla 3).
Tabla 2. Proporciones de una dieta baja en FODMAP
| Menos de 0.3 g por porción de oligosacaridos (productos a base de granos, legumbres, nueces y aceites de semillas) o menos de 0.2 g por porción de oligosacáridos (legumbres, nueces, semillas, frutas y vegetales, productos a base de granos) |
| Menos de 0.4 g por porción del total de polioles |
| Menos de 0.4 g por porción de exceso de fructosa |
| Menos de 1 g por porción de lactosa |
Tabla 3. Tablas de alimentos según el contenido de FODMAP6
| Bajo | Moderado | Alto | |
|---|---|---|---|
| Verduras | Acelga Alfalfa Arúgula Brócoli Calabaza Chayote Chile Ejotes Espinacas Germen de soya Huitlacoche Jícama Pepino Pimientos Zanahoria | Berenjena Col blanca Col morada Jitomate Kale (berza) Lechuga | Alcachofa Apio Ajo Betabel Cebolla Champiñones Chícharos Coles de bruselas Coliflor Espárragos Hinojo (bulbo) Rábanos Setas Shallot |
| Frutas | Arándanos Fresas Kiwi Limón Mandarina Melón Naranja Papaya Piña Pitaya Tamarindo Toronja Uvas | Dátil (2 piezas) Guayaba Plátano | Cerezas (1 taza) Ciruela Durazno Frambuesa (1 taza) Granada Higo Mango Manzana Nectarina Pera Sandía (1 taza) Zarzamora (2/3 taza) Fruta deshidratada |
| Lácteos | Leche deslactosada Mantequilla Quesos duros (manchego, parmesano) Yogur deslactosado Yogur griego | Requesón Queso fresco | Kéfir (200 ml) Leche condensada Leche entera Leche evaporada Queso crema Yogur natural |
| Cereales | Amaranto Arroz Avena Corn flakes Camote Maíz Palomitas Papa Quinoa Rice cakes Tortillas de maíz | Cebada Centeno Cous cous Trigo y derivados (pan, harina, pasta, sémola) | |
| Grasas | Aceites vegetales (canola, girasol, oliva) Cacahuate Mayonesa Nueces Semillas de calabaza, girasol y chía | Aguacate Almendra Coco seco Nuez de la India Pistache | Leguminosas | Hummus Edamame | Alubias Frijoles Haba Lenteja Soya texturizada Tofu, suave | Bebidas | Café Jugos/licuados (frutas y verduras permitidas) Té blanco Té matcha Té menta Té verde | Agua de coco comercial Café con leche entera Jarabes Jugos de fruta (manzana, naranja) Kombucha Refrescos con o sin azúcar Té chai Té hinojo | Azúcares | Azúcar blanco Azúcar moreno Chocolate negro Glucosa Jarabe de maple Estevia natural | Miel (1 cucharadita) Mermeladas | Chocolate con leche Fructosa Jarabe de agave Jarabe de maíz de alta fructosa Manitol Sorbitol | Alimentos de origen animal | Bajo contenido: todos (borrego, puerco, res, huevo, mariscos, pescados, pavo, pollo, ternera) |
| Condimentos | Bajo contenido: cilantro, perejil, albahaca, eneldo, orégano, canela, clavo, comino, cúrcuma, curry, menta, mostaza, paprika, romero, sriracha (1 cucharadita), salsa soya (2 cucharadas), vainilla, vinagres | ||
|
Fuente: Aplicación de la Universidad de Monash©. |
|||
Beneficios y limitaciones a largo plazo
En un metaanálisis que incluyó seis ensayos clínicos aleatorizados, con un total de 182 pacientes que siguieron una dieta baja en FODMAP y 172 pacientes que continuaron con su dieta habitual estándar, se evaluaron la distensión abdominal y otros síntomas gastrointestinales de manera basal y a las 3 y 6 semanas7. El metaanálisis halló una reducción significativa en la distensión abdominal, evaluada por el cuestionario de gravedad de los síntomas (IBS-SSS, Irritable Bowel Syndrome Symptom Severity Score), en el grupo de pacientes que siguió una dieta baja en FODMAP7.
En otro metaanálisis de 12 ensayos clínicos aleatorizados que valoraban el efecto de una dieta baja en FODMAP sobre los síntomas gastrointestinales, incluyendo distensión abdominal objetiva y subjetiva, se compararon los efectos de 3 a 6 semanas de una dieta baja en FODMAP frente a cualquier otra intervención dietética8. El metaanálisis concluyó que la dieta baja en FODMAP fue la intervención que demostró mayor mejoría en la distensión abdominal, comparada con otras intervenciones dietéticas8.
Ciertas limitaciones y desventajas se han observado con la implementación de esta dieta, como el impacto en la microbiota intestinal, la poca adherencia al tratamiento por parte del paciente y que se requieren profesionales de la salud (nutriólogos o médicos especialistas) entrenados en su uso, además de la falta de estandarización del contenido en FODMAP de los alimentos en México9.
Los pacientes que estén siguiendo una dieta baja en FODMAP por tiempo prolongado tienen riesgo de presentar deficiencias nutrimentales (calcio, hierro, zinc, vitamina D, folatos y tiamina); por este y otros motivos, el manejo debe estar guiado por un nutriólogo o especialista en el tema10.
Siempre se debe abordar al paciente de manera individualizada, evitando dietas estandarizadas, valorando la disponibilidad de tiempo y el acceso a alimentos para lograr interés y apego por parte del paciente; de lo contrario, nos exponemos a una nula o poca adherencia.
Impacto en la microbiota intestinal
Al restringir una gran variedad de alimentos, la microbiota intestinal se ve alterada de forma negativa, disminuyendo el número de Bifidobacterium y Faecalibacterium prausnitzii, y aumentando Clostridium sp. La disminución del aporte de fibra y antioxidantes (flavonoides, carotenoides)2 también puede llevar a una disminución en la concentración de ciertos ácidos grasos de cadena corta, como el propiónico y el valérico, que son importantes para la salud intestinal11,12.
Intolerancias alimentarias en el síndrome de intestino irritable
Lactosa, fructosa, sorbitol y gluten: ¿culpables comunes?
Además de los FODMAP, diversos alimentos y patrones dietéticos están asociados con intolerancias que pueden agravar los síntomas del SII. La malabsorción de la fructosa, presente en las frutas, la miel y los jarabes, así como en productos ultraprocesados, puede causar síntomas debido a su fermentación en el colon, mediante una absorción insuficiente de fructosa por los enterocitos en relación con la cantidad de fructosa luminal. En los humanos, la capacidad de absorción de la fructosa en el intestino delgado es mucho menor que la de la glucosa; sin embargo, en combinación con la glucosa, la capacidad de absorción de la fructosa aumenta debido a la absorción adicional de fructosa asociada con el cotransporte de Na+-glucosa.
La malabsorción de la fructosa ocurre cuando la cantidad de fructosa libre excede la capacidad de absorción (en especial cuando hay más fructosa que glucosa). También puede deberse a una insuficiente digestión intracelular o un transporte deficiente.
Existe una gran variabilidad individual en la capacidad de absorción de la fructosa; entre un 10% y un 55% de las personas sanas no absorben completamente 25 g de fructosa. Las dosis menores de 25 g suelen ser bien toleradas. La glucosa estimula la absorción de la fructosa de forma dependiente de la dosis, y se produce malabsorción cuando la fructosa libre está presente en exceso. La fructosa no absorbida pasa al colon y ahí fermenta13.
Métodos diagnósticos para intolerancias alimentarias
La utilidad clínica de las pruebas de aliento es debatida, ya que los pacientes pueden mejorar con una dieta restrictiva sin pruebas positivas y viceversa. Lo anterior refleja la complejidad diagnóstica y la necesidad de evaluar los síntomas clínicos junto con las pruebas, considerando también el contexto dietético y la interacción con otros hidratos de carbono14.
Por otro lado, cabe mencionar que no hay suficiente evidencia para recomendar un panel de alergias que evalúen las inmunoglobulinas (Ig) G, a pesar de que con frecuencia lo solicitan los pacientes. Según las guías actuales, la IgG 4 sérica específica de los alimentos solo indica la exposición repetida a los componentes de los alimentos y no representa alergia, intolerancia ni sensibilidad, y por ende no debería recomendarse su uso14,15.
Fibra y síndrome de intestino irritable: ¿aliada o enemiga?
Las fibras dietéticas son hidratos de carbono de origen vegetal que no pueden ser digeridos por el cuerpo humano e impactan de manera distinta según las características funcionales. Las fibras pueden categorizarse de acuerdo con su solubilidad en dos tipos: solubles e insolubles. También pueden clasificarse por su grado de fermentabilidad, y las fibras rápidamente fermentables (como los fructanos y los galactooligosacáridos) pueden generar síntomas en personas con hipersensibilidad visceral, por lo que su restricción puede reducir la fermentación colónica y aliviar los síntomas en el SII y la dispepsia funcional. Sin embargo, limitar la fermentación colónica puede afectar un poco la composición de la microbiota, la cual se puede restaurar con la reintroducción gradual de fermentación.
La evidencia científica ha demostrado que la fibra dietética desempeña un papel importante en la inflamación intestinal, por su fermentación en ácidos grasos de cadena corta en los colonocitos. Estos ácidos grasos de cadena corta contribuyen a tener una mayor diversidad en la microbiota intestinal y protegen de la disbiosis intestinal16. Sabido esto, se postula que las dietas bajas en fibra promueven la inflamación intestinal y que las dietas altas en fibra protegen frente a procesos inflamatorios.
Fibras como el Psyllium, el salvado de trigo, la fibra de nopal y el bagazo de la caña de azúcar pueden ser de utilidad en los pacientes con SII con predominio de estreñimiento. El Psyllium, el nopal y el bagazo de caña son fibras poco fermentables. La suplementación con Psyllium fue mejor tolerada que con salvado de trigo, posiblemente por la fermentabilidad de este último. La fibra de nopal mejoró los síntomas generales, pero no demostró efecto en laxación17. Las fibras fermentables, como los fructanos, los galactooligosacáridos y la polidextrosa, tienen poco efecto en el estreñimiento17.
La suplementación con fibras fermentables (3-24 g/día) en pacientes con TIIC, como el SII, puede promover el crecimiento de bacterias benéficas, como las bifidobacterias. Sin embargo, esta modulación en la microbiota intestinal no siempre se traduce en una mejoría de los síntomas gastrointestinales en los pacientes con TIIC.
Dieta sin gluten en el síndrome de intestino irritable: ¿estrategia válida o moda pasajera?
En un estudio en pacientes con sensibilidad al gluten no celiaca autorreportada, los fructanos, y no el gluten, fueron los que indujeron síntomas gastrointestinales18. No se encontró diferencia significativa en el grupo con gluten comparado con el grupo con placebo, mientras que la ingestión de fructanos produjo síntomas mayores. Esto sugiere que los fructanos podrían ser los verdaderos desencadenantes de los síntomas en estos pacientes, dejando en duda la necesidad de una dieta libre de gluten en personas que se autodiagnostican con sensibilidad al gluten18.
La evidencia científica disponible respecto a una dieta libre de gluten para pacientes con SII, especialmente aquellos con predominio de diarrea, es limitada y a menudo de baja calidad para recomendar su uso. Aunque algunos pacientes puedan experimentar una mejora en los síntomas con una dieta libre de gluten, esto es insuficiente para recomendarla de manera generalizada. Se requiere más investigación para entender mejor los mecanismos y la eficacia de tales intervenciones dietéticas19,20.
En la tabla 4 se resume la evidencia existente sobre estas y otras intervenciones dietéticas para tratar los síntomas del SII.
Tabla 4. Evidencia sobre otras dietas utilizadas para tratar el síndrome de intestino irritable
| Tipo de dieta | Descripción | Evidencia |
|---|---|---|
| Libre de lactosa | Evitar cualquier producto con lactosa durante 2 semanas, y si los síntomas mejoran, se sugiere continuar con dieta libre de lactosa. Si los síntomas persisten, se pueden reintroducir alimentos con lactosa | Útil para pacientes con intolerancia a la lactosa; sin efectividad para pacientes con SII sin intolerancia a la lactosa |
| Baja/libre de fructosa | Evitar alimentos altos en fructosa y fructanos | Estudios observacionales y ensayos clínicos aleatorizados Efectos benéficos en los síntomas, pero depende del apego Los datos se limitan a pacientes con SII y pruebas de aliento o malabsorción de fructosa | Libre de gluten | Eliminar trigo, cebada y centeno en cualquier presentación | Evidencia insuficiente para recomendarla en pacientes con SII |
| Basada en pruebas de IgG | Elimina los alimentos con pruebas de anticuerpos IgG aumentados | En comparación con controles sanos, los pacientes con SII parecen presentar niveles más altos de anticuerpos IgG; sin embargo, la intensidad de los síntomas no parece correlacionarse con los títulos de anticuerposAl seguir una dieta de evitación de IgG, los pacientes con SII experimentaron una pequeña reducción de los síntomas, que varió según el grado de cumplimiento (10‑26%) en comparación con una dieta simulada | Muy baja en hidratos de carbono o cetogénica | < 20 g/día de hidratos de carbono, 5% de las calorías diarias (frente al promedio del 55%) | Solo un estudio con 13 pacientes con SII con predominio de diarrea; el 77% notaron mejoría en síntomas, especificamente en frecuencia y consistencia de las evacuaciones, calidad de vida y puntajes de dolor |
| Suplementación de fibra | Psyllium, aumento gradual (2-3 g/día) del consumo de fibra (soluble) a partir de la dieta o con suplementos | Varios ensayos clínicos aleatorizados y metaanálisisLa fibra soluble es ligeramente más efectiva que el placebo para el manejo de los síntomas de SII; la fibra insoluble es inefectiva | Baja en grasa | < 27 g/día, considerando una dieta de 2000 kcal | Algunos estudios observacionales y ensayos no controlados, pero no ensayos clínicos aleatorizados | Baja en fibra | < 10-15 g/día | Sin evidencia disponible; la práctica común recomienda disminuir la fibra en pacientes con diarrea para incrementar el tiempo de tránsito |
| Baja en histamina | Disminuir la cantidad de alimentos que liberan histamina: alcohol, huevo, pescados, carne, quesos añejos, nueces, ciertas frutas, chocolate | Sin evidencia que apoye su utilidad en el SII |
|
IgG: inmunoglobulina G; SII: síndrome de intestino irritable. Basada en Werlang et al.1. |
||
Papel de la microbiota intestinal en la respuesta dietética
Disbiosis intestinal y su influencia en los síntomas
La disbiosis intestinal está vinculada al SII mediante varios mecanismos. Diversos estudios han mostrado que las poblaciones con SII presentan un patrón característico en la microbiota intestinal. Específicamente, en el SII con predominio de estreñimiento hay un aumento de Firmicutes (Clostridium spp.), Alistipes y Butyricimonas, mientras que el subtipo de SII con predominio de diarrea muestra un aumento de Enterobacteriaceae, Acinetobacter, Butyricimonas y Odoribacter, y una disminución en la diversidad de la microbiota fecal.
Se ha demostrado que la microbiota fecal de los sujetos con SII difiere significativamente de la de los sujetos sanos (p < 0.0253) y puede influenciar el tránsito colónico, contribuyendo a las alteraciones en el patrón intestinal21.
Uso de probióticos y prebióticos en el manejo dietético del SII
El uso de probióticos y prebióticos en el SII tiene un resplado variable según el subtipo de la enfermedad y las cepas específicas utilizadas. La evidencia científica sugiere que los probióticos pueden ser efectivos para mejorar los síntomas del SII, mientras que los prebióticos aún no han demostrado beneficios claros.
Específicamente la cepa Bifidobacterium infantis 35624 ha mostrado normalizar la relación anormal de interleucinas 10 y 12, y aliviar los síntomas del SII, a excepción de la frecuencia y la consistencia de las deposiciones, con un efecto dependiente de la dosis. Otras cepas con evidencia de mejora en dolor abdominal, frecuencia intestinal y calidad de vida en pacientes con SII con predominio de diarrea son Lactiplantibacillus plantarum y Bacillus coagulans. En el SII con predominio de estreñimiento se ha observado que la administración de Lactobacillus helveticus durante 1 semana mejoró los síntomas abdominales asociados con el estreñimiento y redujo el tiempo de tránsito intestinal22.
Las cepas específicas asociadas con reducción del dolor abdominal en el SII incluyen Bacillus coagulans MTCC5260, Saccharomyces boulardii CNCM I-745, Saccharomyces cerevisiae CNCM I-3856 y Lactiplantibacillus plantarum 299v. Sin embargo, para la distensión abdominal el grado de evidencia sobre el beneficio de la combinación de cepas fue muy baja22.
Debido a la heterogeneidad de los estudios y la baja calidad de la evidencia, la American Gastroenterological Association y el American College of Gastroenterology no recomiendan formalmente el uso de probióticos y prebióticos para el SII23.
A pesar de existir algunos estudios preclínicos prometedores, la evidencia clínica no respalda el uso de prebióticos para el SII, ya que no han mostrado mejoras significativas en los síntomas24,25.
Intervenciones dietéticas emergentes
No se dispone de información respecto al efecto del ayuno intermitente en los pacientes con SII. Sin embargo, hay un pequeño estudio con 21 musulmanes sanos que practicaron el ramadán (modelo de ayuno intermitente) y se evaluaron sus efectos en la motilidad gastrointestinal26. El estudio conluye que todos los sujetos mostraron una disminución en el peso, el índice de masa corporal y la circunferencia de la cintura, en conjunto con una disminución de la grasa subcutánea y visceral, y de la resistencia a la insulina. Después del ayuno, las pruebas de aliento con hidrógeno mostraron un incremento en la fermentación de hidratos de carbono y un tránsito orocecal más rápido25. Hacen falta estudios, especialmente en humanos y con la enfermedad, para poder determinar su eficacia y su mecanismo de acción en el SII.
Herramientas de evaluación nutricional en el síndrome de intestino irritable
Dado que el SII presenta los subtipos de diarrea, estreñimiento y mixto, es fundamental conocer los desencadenates para orientar el manejo dietético. La principal herramienta que puede ser de utilidad para identificar detonantes es el diario o bitácora de alimentos, donde se solicita al paciente que monitorice y registre los alimentos consumidos previamente a la aparición de síntomas con la finalidad de poder relacionarlos con ellos. La figura 1 muestra un ejemplo de formato de bitácora que el paciente puede llenar. Otras opciones son:
- – Diario de evacuaciones: se registran la frecuencia y la apariencia de las evacuaciones utilizando la escala de Bristol.
- – Recordatorio de 24 horas: interroga todos los alimentos ingeridos el día anterior (o un día habitual) y permite identificar si se consumen suficientes frutas y verduras, si se excede en productos industrializados, si la dieta es alta en grasa, etc.
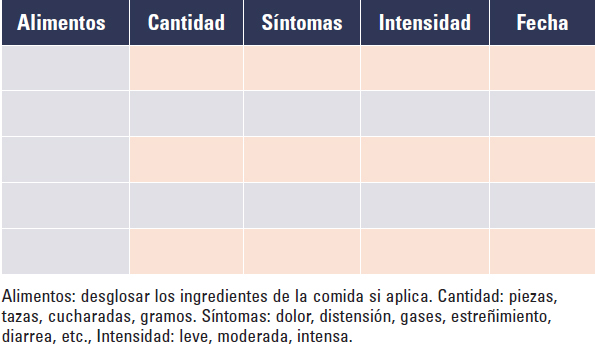
Figura 1. Ejemplo de una bitácora de alimentos como herramienta de evaluación.
El monitoreo del paciente siempre debe realizarlo un nutriólogo calificado que sea capaz de reconocer los tipos de alimentos y las cantidades a las que el paciente puede ser hipersensible, y que aconseje sustituciones adecuadas. Estos métodos enfocados en adaptar y personalizar el tratamiento de cada individuo disminuyen el riesgo de deficiencias nutricionales y generan un mejor apego.
Desafíos y controversias en las intervenciones dietéticas
Tuck et al.4 evaluaron la respuesta en cada una de las fases de la dieta baja en FODMAP en 80 pacientes, y observaron que el 78% siguieron la dieta durante la fase 1 (restricción), pero esto se redujo en un 30% para la fase 2 (reintroducción) y en un 8% adicional para la fase 3 (personalización), lo que resultó en que solo el 40% siguieron adecuadamente las tres fases. Por ello, se propone un enfoque alternativo menos restrictivo y basado en el historial dietético, denominado Bottom-up. En este abordaje, de forma inicial solo se restringen uno o dos subgrupos específicos de FODMAP, se evalúa la respuesta sintomática y solo se continúa restringiendo si es necesario. Se sugiere empezar con los fructanos, el manitol y los galactooligosacáridos, al ser los subgrupos de FODMAP más reportados como detonantes (Fig. 2)5.
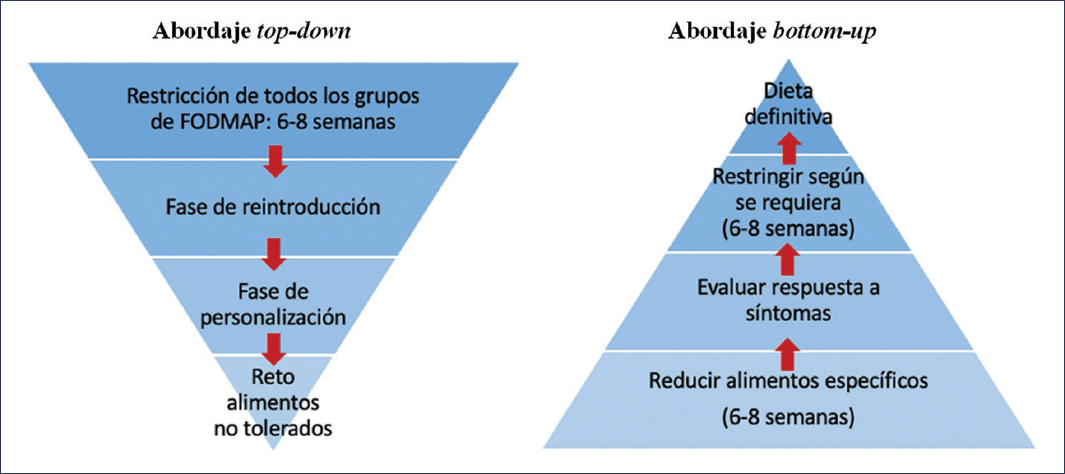
Figura 2. Abordaje alterno (Bottom-up) a la dieta baja en FODMAP tradicional13.
Si bien este enfoque no ha sido bien estudiado, la estrategia Bottom-up implica un buen interrogatorio de los hábitos dietéticos del paciente con el fin de poder identificar los probables detonantes. Por ejemplo, si el paciente utiliza edulcorantes artificiales (en el café, refrescos o bebidas sin azúcar, si mastica chicle o consume mentas, dulces o chocolates sin azúcar) o consume grandes cantidades de frutas o jugos de frutas, comenzar por restringir el exceso de fructosa y de polioles puede dar buena respuesta. Por otro lado, si consume grandes cantidades de trigo, cebolla o leguminosas puede beneficiarse de la restricción de fructanos. También es importante tener en cuenta la intolerancia a la lactosa27.
Después de la restricción inicial de uno o dos alimentos o subgrupos durante aproximadamente 2 semanas, se vuelve a evaluar la respuesta de los síntomas y, si estos han mejorado, no es necesario realizar ningun tipo de restricción adicional. Si los síntomas continúan, se agregan alimentos o subgrupos adicionales a la restricción dietética hasta que se resuelven los síntomas o se observa una falta de respuesta5,27.
Posibles riesgos de las dietas restrictivas prolongadas
Un factor importante que debe considerarse al recomendar una dieta restrictiva o de eliminación son los trastornos de la conducta alimentaria, específicamente la ortorexia nerviosa. Algunos signos y síntomas recogidos en la literatura son revisar las etiquetas nutrimentales compulsivamente, evitar muchos grupos de alimentos, ser incapaz de comer algo que no parezca limpio o sano, y sentir estrés en relación con la comida.
Particularmente, un trastorno que comienza a presentarse en los pacientes con SII es el trastorno evitativo restrictivo de la ingesta de alimentos (TERIA), también conocido como ARFID por sus siglas en inglés. Este se distingue de la anorexia nerviosa por la falta de preocupación por el peso.
Existe muy poca literatura en gastroenterología acerca del TERIA, pero puede ser más común de lo que los médicos imaginan. El grupo del Dr. Chey, en Michigan, reportó que de los más de 300 pacientes atendidos en las clínicas de motilidad y trastornos del eje intestino-cerebro, el 20% resultaron positivos para TERIA28.
Por esta razón, es importante vigilar y evitar restricciones dietéticas extremas o innecesarias que incluso ponen al paciente en riesgo de presentar deficiencias nutricionales a largo plazo.
¿Personalización de la dieta o guías generales?
A manera de conclusión, no existe una dieta estandarizada que vaya a funcionar para todos los pacientes con SII, y por eso promovemos una dieta personalizada, que se adapte al estilo de vida del paciente y a sus gustos, creencias y situación económica.
Hay que enfatizar y explicar al paciente que la tolerancia dependerá mucho de las cantidades y de las combinaciones con otros alimentos. Es recomendable utilizar una bitácora de alimentos en caso de que se presenten síntomas para poder actuar de acuerdo con la información recopilada.
Financiamiento
La autora declara no haber recibido financiamiento para este estudio.
Conflicto de intereses
La autora declara no tener conflicto de intereses.
Consideraciones éticas
Protección de personas y animales. La autora declara que para esta investigación no se han realizado experimentos en seres humanos ni en animales.
Confidencialidad, consentimiento informado y aprobación ética. El estudio no involucra datos personales de pacientes ni requiere aprobación ética. No se aplican las guías SAGER.
Declaración sobre el uso de inteligencia artificial. La autora declara que no utilizó ningún tipo de inteligencia artificial generativa para la redacción de este manuscrito.
