Introducción
El síndrome de intestino irritable (SII) es un trastorno de la interacción intestino-cerebro (TIIC) cuya fisiopatología se relaciona con cualquier combinación de alteraciones de la motilidad, sensibilidad visceral, barrera epitelial, función inmunitaria de la mucosa, disbiosis intestinal o procesamiento a nivel del sistema nervioso central1. Debido a su carácter multifactorial, el diagnóstico se realiza basándose en criterios sintomáticos. En el Estudio Epidemiológico Global de la Fundación de Roma, utilizando los más recientes criterios de Roma IV (véase más adelante), se encontró que, en México, el 40.2% de la población general cumple criterios para al menos un TIIC, y la prevalencia del SII fue del 4%2. El SII comúnmente se refiere como el principal motivo de consulta al gastroenterólogo3,4; sin embargo, entre los sujetos que reportaron síntomas compatibles con SII, solo buscaban atención médica un poco más de la mitad de ellos, acudiendo principalmente a médicos generales, seguidos por gastroenterólogos2. De hecho, en un estudio reciente que realizamos en México se determinó que el SII constituye apenas el séptimo motivo de consulta al gastroenterólogo especializado5.
El diagnóstico de SII se basa en la aplicación de los criterios de Roma, los cuales han evolucionado según la evidencia hasta los más recientes de Roma IV6, que permiten identificar el trastorno a partir de síntomas específicos. No obstante, debido a la sobreposición de síntomas con los de otras enfermedades intestinales, es fundamental una evaluación adecuada para descartar patologías con manifestaciones similares, tales como la enfermedad inflamatoria intestinal, la enfermedad celíaca o trastornos de malabsorción1.
En esta revisión analizaremos los criterios de Roma IV para SII, la escala de Bristol, el diagnóstico diferencial, los criterios de alarma, los criterios clínicos, las pruebas diagnósticas y los biomarcadores, y el perfil clínico multidimensional (PCMD). El objetivo es que el presente artículo sirva como una guía completa para el clínico interesado en el diagnóstico del SII, principalmente en México, pero también para el investigador en el campo.
Criterios diagnósticos de Roma IV
En la década de 1980, a los TIIC se les denominaba «trastornos funcionales gastrointestinales», refiriéndose así a cualquier trastorno con sintomatología gastrointestinal cuando el resto de las posibles explicaciones se habían descartado. Al tratarse de una afección carente de biomarcadores, era vista como un «diagnóstico de exclusión». En 1988, un artículo de revisión recalcó la intermitencia del dolor abdominal y la variedad en la consistencia de las heces en los pacientes7. Esto fue un precedente importante para la creación de la Fundación Roma, cuyos miembros publicarían su primer libro (Roma I) en 1994, dando así origen a los primeros criterios diagnósticos para los entonces llamados «trastornos funcionales gastrointestinales», que han sido modificados en tres ocasiones más de acuerdo con las evidencias disponibles, en 2000 (Roma II), 2006 (Roma III) y los más recientes en 2016 (Roma IV)8. Estos criterios clasifican los TIIC en 32 categorías diagnósticas distribuidas según el órgano blanco: esofágicos, gastroduodenales, intestinales, anorrectales, vía biliar y dolor abdominal mediado centralmente9. Como tal, el SII hace parte de los trastornos intestinales y es el más investigado, aunque no necesariamente el más prevalente (en la actualidad lo es el estreñimiento funcional)10. Es de anotar que los criterios de Roma IV son un trabajo en progreso y la nueva iteración, Roma V, se encuentra en desarrollo y será publicada en mayo de 202611.
Debido al carácter multifactorial y la ausencia de biomarcadores diagnósticos del SII, como de los demás TIIC, es necesario que el paciente cumpla en primera instancia con los criterios diagnósticos de Roma IV. Sin embargo, aun cuando hay TIIC que se diagnostican exclusivamente por criterios clínicos o síntomas, como es el caso del SII y el estreñimiento funcional, hay otros TIIC que requieren además pruebas diagnósticas, como es el caso de la hipersensibilidad al reflujo y la pirosis funcional, que requieren el monitoreo de pH-impedancia, o la disinergia del piso pélvico o anismo, que necesita manometría anorrectal12.
Como ya se mencionó, es importante recalcar el hecho de que, hasta el momento, no se han encontrado biomarcadores confiables para el SII; si bien existe mucha actividad de investigación para tratar de identificarlos13, ningún estudio de sangre, orina, heces, imagen, endoscopia o biopsia puede reemplazar el uso de los criterios basados en síntomas (criterios de Roma)14.
Los criterios diagnósticos de Roma IV para el SII son los siguientes:
- – Dolor abdominal recurrente al menos un día por semana en los últimos 3 meses; y
- – Asociado con al menos dos de los siguientes factores:
- La defecación (el dolor mejora o aumenta).
- Cambios en la frecuencia de las deposiciones (el dolor se asocia con evacuaciones más o menos frecuentes).
- Cambios en la forma o la apariencia de las heces (el dolor se asocia con evacuaciones más duras o sueltas de lo normal).
Además, los síntomas deben estar presentes en los 3 meses previos y haber comenzado al menos 6 meses antes del diagnóstico6.
Es importante considerar los cambios más importantes que se presentan en la versión de Roma IV en comparación con Roma III. En particular, el cambio más relevante es la eliminación del concepto de «malestar» de la definición (en Roma III era «dolor o malestar abdominal»), siendo ahora requisito el presentar únicamente dolor abdominal al menos una vez por semana para poder establecer el diagnóstico, mientras que en Roma III el dolor o malestar debía estar presente dos o más veces por mes, lo cual lo hacía menos estricto. Además, en Roma III se consideraba que el dolor abdominal solo podía mejorar con la evacuación, y Roma IV considera también la posibilidad de que esta pueda incrementar el dolor15. Con respecto a los cambios introducidos por Roma IV, la modificación del marco de tiempo parece ser el factor más importante sobre la prevalencia global del SII, la cual disminuyó en más del 50% de Roma III a Roma IV (10.1% a 4.1%)16.
En segunda instancia, se clasifica al SII en uno de los cuatro posibles subtipos de acuerdo con el hábito intestinal predominante: SII con diarrea (SII-D), SII con estreñimiento (SII-E), SII mixto (SII-M) y SII no clasificable (SII-NC). Para clasificarlos es necesario tomar en cuenta el tipo de evacuaciones anormales que predominan en el paciente, utilizando el umbral del 25% durante los días con evacuaciones anormales (Tabla 1). Lo anterior significa que si el paciente refiere tener evacuaciones con hábito intestinal alterado (líquidas, muy duras o ambas) en 5 de 7 días a la semana, se consideran los 5 días como la base del 100%; por el contrario, si refiere tener evacuaciones anormales durante los 7 días de la semana, entonces se consideran 7 días como la base del 100%6.
Tabla 1. Subtipos de síndrome de intestino irritable según Roma IV
| Subtipo | Criterios | Pacientes |
|---|---|---|
| SII-D | Al menos el 25% de las heces son de los tipos 6 o 7 de Bristol, y menos del 25% son tipos 1 y 2 de Bristol | Refieren que las evacuaciones anormales son usualmente con diarrea |
| SII-E | Al menos el 25% de las heces son de los tipos 1 o 2 de la escala de Bristol, y menos del 25% son tipos 6 y 7 de Bristol | Refieren que las evacuaciones anormales son usualmente con estreñimiento |
| SII-M | Al menos el 25% de las heces corresponden a los tipos 1 y 2 de Bristol, y al menos el 25% a los tipos 6 o 7 de Bristol | Refieren que las evacuaciones anormales son usualmente con estreñimiento y diarrea |
| SII-NC | Cumple con criterios diagnósticos para SII, pero no predomina ningún tipo de forma de heces más allá del 25% | Refieren que son raras las evaciaciones anormales |
|
D: diarrea; E: estreñimiento; M: mixto; NC: no clasificable; SII: síndrome de intestino irritable. |
||
Escala de Bristol para la forma de las evacuaciones
El subtipo de SII se basa principalmente en la escala de Bristol, que distingue siete subtipos según el tránsito intestinal (Fig. 1).
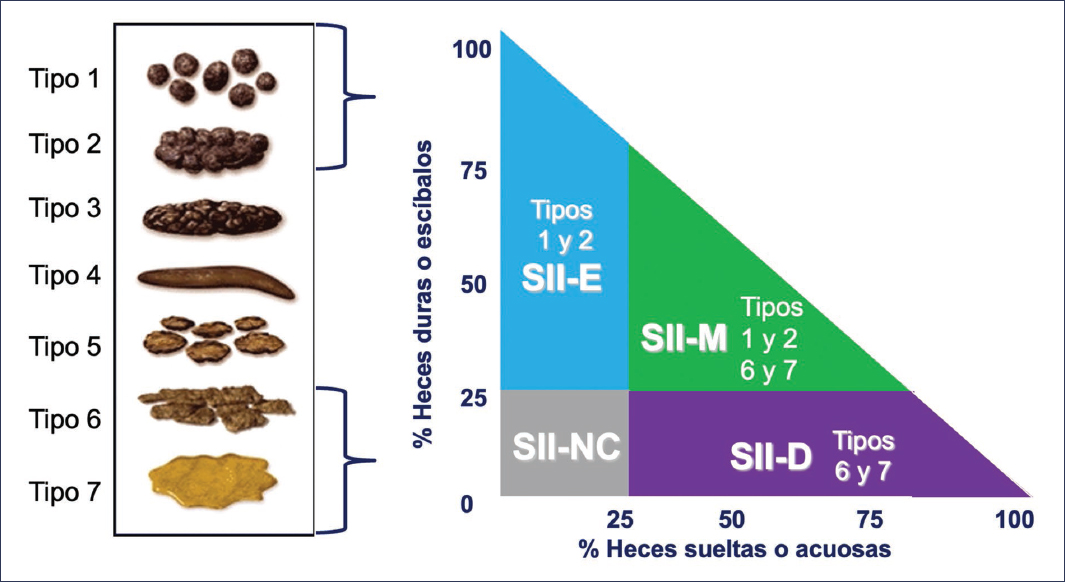
Figura 1. Escala de Bristol.
Diagnóstico diferencial
Hay un gran número de padecimientos orgánicos que podrían cumplir con estos mismos criterios para SII; sin embargo, una variedad de asociaciones que pueden estar presentes en pacientes con SII, pero no suelen ser tan comunes en pacientes con trastornos orgánicos, apoyan el diagnóstico de SII17. (Tabla 2). Por ejemplo, un hábito intestinal impredecible (tres o más tipos de forma de las heces a la semana) se ha demostrado que es más común en el SII-D, mientras que cuanto mayor incremento en el número de días consecutivos sin evacuar, mayor asociación con SII-E. La urgencia para evacuar y el moco en las evacuaciones se asocia más con SII-D, mientras que el tenesmo excesivo para evacuar y la sensación de vaciamiento incompleto se asocian más con SII-E18. Dentro de los síntomas digestivos extraintestinales puede encontrarse asociación con dispepsia, saciedad temprana, náusea, dolor epigástrico y plenitud posprandial18,19. De hecho, en un estudio que realizamos en México hace varios años en pacientes con SII mediante los criterios de Roma III que consultaban al médico, encontramos que aquellos con SII-M reportaban mayor frecuencia y más intensidad de síntomas como halitosis y vómito, y mayor intensidad de eructos, mientras que aquellos con SII-E tenían mayor frecuencia e intensidad de pujo, y aquellos con SII-D presentaban mayor urgencia, incontinencia fecal y moco en las evacuaciones20. Estos síntomas se suelen encontrar hasta en un tercio de los pacientes y se correlacionan positivamente con un aumento en la incapacidad laboral y la necesidad de atención médica21. Dentro de los síntomas extradigestivos o extraintestinales encontramos una diversidad importante que apoyan el diagnóstico de SII, todos relacionados con alteraciones del eje microbiota-cerebro, como son fibromialgia, síndrome de fatiga crónica, dolor pélvico crónico, trastornos de la articulación temporomandibular, cefalea, dolor de cuello y espalda, mialgias, fatiga, cansancio, mareo, migraña, palpitaciones, dolor torácico, bochornos, trastornos del sueño, disminución de la libido, dispareunia, frecuencia y urgencia urinaria, nocturia, ansiedad, depresión, dificultad respiratoria, asma, tos, prurito y halitosis22,23.
Tabla 2. Diagnósticos diferenciales de síndrome de intestino irritable en la práctica clínica
| Diarrea crónica | Gastrointestinales | Enfermedad celiaca | Sobrepoblación bacteriana del intestino delgado | Infección crónica | Neoplasia colónica | Enfermedad inflamatoria intestinal | Colitis ulcerativa | Enfermedad de Crohn | Otras | Hipertiroidismo | Hipoparatiroidismo | Diabetes | Fármacos (inhibidores de la bomba de protones, procinéticos, metformina, colchicina) | Estreñimiento crónico | Gastrointestinales | Estreñimiento funcional | Estreñimiento inducido por opiáceos | Trastornos funcionales de la defecación | Disinergia de la defecación | Propulsión defecatoria inadecuada | Estreñimiento de tránsito lento | Trastornos de la evacuación | Otras | Fármacos (bloqueadores de los canales de calcio, antiinflamatorios no esteroideos) | Enfermedad de Parkinson | Diabetes mellitus | Enfermedades del tejido conectivo | Síndrome de Ehlers-Danlos | Trastornos del estado de ánimo |
Criterios de alarma
Como se ha mencionado anteriormente, el diagnóstico del SII se basa en la información obtenida de la anamnesis, debiendo cumplir con los criterios definidos por Roma IV. Es oportuno destacar que hasta el 24% de los pacientes con enfermedades orgánicas pueden llenar criterios de Roma, incluyéndose enfermedad inflamatoria intestinal, enfermedad celiaca, intolerancia a la lactosa y colitis microscópica, entre otras24. Por lo tanto, se debe realizar una exploración física completa con el objeto de descartar signos de alarma, y dar seguridad al paciente de que no presenta ninguna otra enfermedad. Los datos de alarma que se deben buscar de manera sistemática son pérdida de peso no intencionada (> 10% en 3 meses), sangre en heces no causada por hemorroides o fisuras anales, diarrea de predominio nocturno, fiebre y antecedentes familiares de enfermedad inflamatoria intestinal o enfermedad celiaca6. Por ejemplo, en el SII-D, la ausencia de datos de alarma reduce la razón de verosimilitud de una enfermedad orgánica25, además de que presentan unas bajas sensibilidad y especificidad para el diagnóstico de cáncer colorrectal26. Por ello, la selección de pruebas diagnósticas se deberá guiar de manera individual en un determinado contexto clínico6,27.
Por lo anterior, una vez confirmados los criterios diagnósticos de Roma IV para SII, y considerando que es fundamental descartar una causa orgánica para los síntomas, es necesario establecer con precisión qué estudios complementarios son requeridos para confirmar la naturaleza funcional del trastorno (véanse los apartados dedicados los biomarcadores y al PCMD).
Criterios clínicos
Los criterios de Roma presentan una alta sensibilidad para realizar el diagnóstico de SII basándose en los síntomas. Estos son de particular valor para la investigación epidemiológica, los estudios de fisiopatología y los ensayos clínicos1,8. Si bien sirven para guiar el diagnóstico en la clínica, pueden ser difíciles de aplicar en la práctica médica, resultando así un desafío para los médicos y los gastroenterólogos. Lo anterior se debe a que muchos pacientes no cumplen los criterios de síntomas en el marco de tiempo requerido, lo cual es conocido como «diagnóstico subumbral»; sin embargo, este grupo de pacientes reciben el mismo tratamiento que aquellos que sí cumplen los criterios en su totalidad28. Por otra parte, es importante considerar que, por lo general, los pacientes con sospecha de SII consultan al médico cuando sus síntomas son lo suficientemente molestos como para afectar su vida diaria29. En este sentido, y de acuerdo con la limitante de los criterios de Roma para su aplicación en la clínica, por consenso, el Consejo Directivo de la Fundación Roma desarrolló una modificación de los criterios diagnósticos de Roma IV para la práctica clínica, conocidos como «criterios clínicos»8. Se propusieron cuatro factores para estos criterios clínicos:
- – Naturaleza de los síntomas: los síntomas deben llenar las características cualitativas de los criterios de Roma IV, los cuales han sido respaldados y validados por estudios epidemiológicos, de análisis factorial y de cohortes clínicas, entre otros.
- – Malestar-interferencia con la vida diaria: se ha recomendado considerar como criterio clínico para el diagnóstico el reporte mismo de los pacientes de que los síntomas son lo suficientemente molestos para interferir con sus actividades diarias.
- – Frecuencia de los síntomas: se ha recomendado que la frecuencia de los síntomas no sea un criterio obligatorio para el diagnóstico de SII, ya que, como se mencionó anteriormente, los pacientes acuden a consulta médica debido a que los síntomas impactan tanto en su vida diaria como para buscar atención médica. Lo anterior permite considerar una frecuencia de los síntomas inferior al umbral establecido por Roma IV.
- – Duración de los síntomas (marco de tiempo): si bien Roma IV establece que los síntomas estén presentes durante los 3 meses previos, con inicio de los síntomas al menos 6 meses antes del diagnóstico, se acepta que los síntomas hayan estado presentes durante las 8 semanas previas para así garantizar el haber descartado otros diagnósticos. Existen dos excepciones para cumplir este requisito de duración: a) cuando el médico necesite realizar un diagnóstico temprano y esté convencido de que la evaluación médica realizada haya descartado otras enfermedades, y b) para diagnósticos en los que los síntomas se presentan con poca frecuencia y de manera intermitente (p. ej., síndrome de vómito cíclico, migraña abdominal, dolor biliar y proctalgia fugaz).
Si bien estas pautas se recomiendan para mejorar la implementación de los criterios de Roma en la clínica, es importante mencionar que los médicos deberán evaluar los patrones de síntomas, los factores de riesgo y otras características del paciente para seleccionar estudios adicionales si es necesario. Si todos los elementos concuerdan con un diagnóstico de SII, este se puede establecer con seguridad a pesar de unas menores frecuencia y duración.
Pruebas diagnósticas mínimas y biomarcadores
Actualmente, el único uso clínico de biomarcadores recomendado en el SII consiste en pruebas serológicas para inmunoglobulina A (IgA) antitransglutaminasa tisular, niveles de IgA, proteína C reactiva en sangre y calprotectina fecal30. Estos marcadores no confirman el diagnóstico de SII (biomarcadores de inclusión), sino que se utilizan para descartar enfermedad celíaca y enfermedad inflamatoria intestinal en pacientes con sospecha de SII-D (biomarcadores de exclusión) y características clínicas atípicas o sin signos de alarma. Por ello, ante la falta de un biomarcador específico de inclusión, el diagnóstico del SII sigue basándose en los síntomas6. Sin embargo, aunque los criterios de Roma han mostrado utilidad en ensayos clínicos, estos pueden mostrar ciertas limitaciones en la práctica médica diaria debido a la heterogeneidad clínica de los pacientes, así como por la sobreposición de síntomas y las manifestaciones similares con otras enfermedades31.
No obstante, si se quisiera fundamentar el diagnóstico de SII en un «diagnóstico de exclusión», el estudio de los pacientes podría ser tan extenso que tomaría varios meses o incluso años para establecer el diagnóstico correcto32, pues los médicos deberían excluir la presencia de enfermedad inflamatoria intestinal), enfermedad celiaca, intolerancias alimentarias (a la fructosa y la lactosa) e incluso la presencia de tumores del tracto gastrointestinal33. Las recomendaciones sobre el SII mencionan que es necesario realizar un diagnóstico temprano basado en los síntomas, con un empleo limitado de pruebas diagnósticas extensivas, costosas e invasivas34. A pesar de lo anterior, muchos pacientes siguen siendo evaluados con numerosas pruebas diagnósticas que aplazan el diagnóstico correcto, así como el tratamiento adecuado de su sintomatología. Por ejemplo, en un estudio realizado entre gastroenterólogos miembros de la Sociedad Latinoamericana de Neurogastroenterología, expertos en el diagnóstico de SII, el 98% reportaron utilizar los criterios de Roma IV para diagnosticar el SII. Todos solicitan pruebas de laboratorio ante signos de alarma y el 90% ordenan colonoscopia en los mayores de 50 años, como está establecido en diversas guías internacionales. A pesar de lo anterior, el 73% solicitan una tomografía computada abdominopélvica, demostrando un abuso de estudios innecesarios para el diagnóstico35. Es por ello que es de crucial importancia la investigación de biomarcadores específicos mediante procedimientos accesibles y poco invasivos, que incrementen la precisión diagnóstica y ayuden a establecer mejores tratamientos para el SII.
Antes de continuar, es importante notar que un biomarcador se conceptualiza como una característica objetiva que sirve como indicador de procesos biológicos normales o patológicos, o de la respuesta a una exposición o intervención36. Los biomarcadores pueden tener diferente naturaleza, que va desde lo molecular hasta lo histológico, aspectos radiológicos o de imagenología, o un conjunto de características fisiológicas; además, pueden emplearse en diferentes contextos, como tamizaje, diagnóstico, monitoreo, farmacodinamia, respuesta terapéutica, predictivo o pronóstico36. En otras palabras, el biomarcador ideal debería medir un componente, estructura o función biológica que influye o puede predecir la evolución de un trastorno o enfermedad37. Así mismo, debe tener altas sensibilidad y especificidad, reproducibilidad, costo-efectividad, baja variabilidad interobservador y accesibilidad tanto para el sistema de salud como para el paciente38. La búsqueda de un biomarcador de cualquiera de estas características o propósitos es de vital importancia para el diagnóstico y el manejo del SII.
Hasta el día de hoy no existen marcadores que sean específicos para el diagnóstico de SII, pero se han estudiado algunos que sirven de apoyo al diagnóstico clínico. En 2009, Lembo et al.39 publicaron un estudio que realizaron para desarrollar y validar una prueba diagnóstica basada en biomarcadores séricos con el fin de diferenciar pacientes con SII de aquellos con otras enfermedades gastrointestinales y sujetos sanos39. Los biomarcadores incluidos en el estudio fueron diez: interleucina 1β (IL-1β), oncogén alfa relacionado con el crecimiento (GRO-α), factor neurotrófico derivado del cerebro (BDNF), anticuerpo frente a Saccharomyces cerevisiae (ASCA IgA), anticuerpo antiflagelina CBir1 (anti-CBir1), proteína encontrada en ciertas bacterias y que se ha asociado con enfermedad de Crohn, anticuerpo antitransglutaminasa tisular (anti-tTG), inductor débil de la apoptosis similar al factor de necrosis tumoral (TWEAK), anticuerpo anticitoplasma de neutrófilo (ANCA), inhibidor tisular de la metaloproteinasas 1 (TIMP-1) y lipocalina asociada a la gelatinasa de neutrófilo (NGAL). Este estudio mostró una sensibilidad del 50%, una especificidad del 88%, un valor predictivo positivo del 81% y un valor predictivo negativo del 64%. Aunque la sensibilidad global de los marcadores séricos fue baja, la alta especificidad sugiere que un resultado positivo puede aumentar la precisión diagnóstica de SII39. Finalmente, este panel de biomarcadores séricos podría ser útil como auxiliar diagnóstico al inicio del abordaje clínico, en casos de presentación atípica y para evitar pruebas invasivas innecesarias, en particular en el momento de diferenciar el SII de otros trastornos gastrointestinales no funcionales; sin embargo, el panel no reemplaza a la evaluación clínica del paciente ni debe usarse de forma aislada para diagnosticar SII39.
Posteriormente, Jones et al.40 propusieron un panel de 34 biomarcadores combinados con variables psicológicas (ansiedad, depresión, somatización y estrés) para diferenciar pacientes con SII de individuos sanos y entre subtipos de SII. Este estudio incorporó una estrategia más amplia y moderna, pues tomó los 10 biomarcadores evaluados previamente por el estudio de Lembo et al.39 y agregó 24 nuevos biomarcadores que incluían 14 marcadores basados en expresión génica en sangre periférica y 10 marcadores serológicos nuevos. El panel de 34 biomarcadores de este estudio mostró una sensibilidad del 81% y una especificidad del 64%, y además, al agregar las cuatro variables de la evaluación psicológica estandarizada (ansiedad, depresión, somatización y estrés), el rendimiento mejoró a una sensibilidad y una especificidad ≥ 85%. Así mismo, este panel logró una buena discriminación entre SII-E y SII-D40. Algunos de los marcadores más útiles empleados en este estudio fueron la histamina, relacionada con la activación de mastocitos anti-tTG, marcador de expresión de anticuerpos, y la NGAL, implicada en la regeneración de la mucosa y el transporte molecular. También se evaluaron la IL-6, un importante mediador inflamatorio; el receptor 1 del péptido intestinal vasoactivo (VIPR1), asociado con la inflamación y la motilidad; y TWEAK, involucrado en procesos de inflamación, motilidad y reparación tisular. Además, se analizaron marcadores de expresión génica, como RNF26 (ring finger protein 26), ZNF326 (zinc finger protein 326) y el gen similar a MICAL-1 (MICALL-1), los cuales se asocian con las uniones estrechas y la función de barrera epitelial40. Es así que el panel de Jones et al.40 evalúa biomarcadores relacionados con múltiples mecanismos fisiopatológicos del SII, tales como la inflamación de bajo grado, la disfunción de la barrera epitelial, las alteraciones neuroinmunitarias, la activación de mastocitos y la regulación génica periférica, y además incluye genes y proteínas que combinados con las variables psicológicas refuerzan el modelo biopsicosocial del SII. Por lo tanto, este estudio propone un modelo que distingue SII de sujetos sanos, así como de otras patologías gastrointestinales orgánicas, con adecuada precisión40.
Por otro lado, ciertos estudios han demostrado niveles elevados de citocinas proinflamatorias, como el factor de necrosis tumoral alfa (TNF-α), así como niveles disminuidos de la citocina antiinflamatoria IL-10, en sangre de pacientes con SII, en contraste con sujetos sanos41. Así mismo, se ha descrito que los pacientes con alteraciones inmunitarias también experimentan un tránsito intestinal más acelerado en comparación con aquellos sin activación inmunitaria42. Además, existe una correlación positiva entre los niveles de TNF-α y una menor consistencia de las heces, y por otro lado, los niveles elevados de IL-6 se relacionan con un aumento de la frecuencia del hábito intestinal42.
En modelos animales de SII posinfección (SII-PI), como el de ratas infectadas con Campylobacter jejuni, se ha observado la aparición de un fenotipo similar al DE SII-D, acompañado de alteraciones en la microbiota del intestino delgado43. Un hallazgo clave en este modelo fue la implicación de la toxina bacteriana de distensión citoletal fracción B (CdtB)44. Además, se encontró que la exposición a CdtB inducía la producción de anticuerpos específicos y a través de reactividad cruzada con la vinculina, una proteína de adhesión celular del intestino. Esta reacción cruzada se relacionó con alteración de la motilidad y, por consiguiente, sobrepoblación bacteriana del intestino delgado43–45. Esto último llevó al desarrollo de la prueba serológica para anticuerpos anti-CdtB y antivinculina45.
Como ya se ha mencionado, los biomarcadores podrían tener utilidad no solo para distinguir SII de personas sanas, sino también para diferenciar entre distintos subgrupos dentro del SII. Un ejemplo de ello es el caso de los pacientes que desarrollan dicho trastorno posterior a una infección gastrointestinal (SII-PI). Se estima que aproximadamente el 10% de los individuos que sufren un episodio de gastroenteritis aguda desarrollan síntomas persistentes compatibles con SII-D, lo cual es característico del SII-PI46–48. Basándose en esta evidencia preclínica, en 2015 Pimentel et al.45 realizaron un estudio clínico para evaluar si los anticuerpos anti-CdtB y antivinculina podrían utilizarse como biomarcadores diagnósticos para el SII-D y diferenciarlo de otras causas de diarrea crónica, como enfermedad celiaca y enfermedad inflamatoria intestinal, así como de sujetos sanos. En el estudio se encontró que los niveles de ambos anticuerpos estaban significativamente elevados en los pacientes con SII-D. En particular, los anticuerpos anti-CdtB mostraron un buen desempeño diagnóstico, con un área bajo la curva de 0.81, una especificidad del 91.6% y un valor predictivo positivo del 81%45. En sintonía con lo anterior, en un estudio realizado en población mexicana por Schmulson et al.49 se evaluó la utilidad clínica de los anticuerpos anti-CdtB y antivinculina como herramientas diagnósticas en pacientes con SII-D y SII-M. Se encontró que el 58.8% de los pacientes con SII-D y el 33.3% de aquellos con SII-M presentaron positividad para al menos uno de estos anticuerpos. Además, los pacientes con antecedente de SII-PI mostraron una mayor tasa de positividad (71.4%) en comparación con los casos no posinfecciosos (41.7%), lo cual, si bien no alcanzó significancia estadística, apoya la hipótesis de un mecanismo inmunitario desencadenado por infecciones previas49. Es relevante señalar que estos biomarcadores no fueron positivos en los pacientes con otras causas funcionales u orgánicas de diarrea, lo que subraya su especificidad diagnóstica. Estos hallazgos respaldan el posible uso de los anticuerpos anti-CdtB y antivinculina como herramientas complementarias para el diagnóstico positivo del SII-D y distinguirlo de otras condiciones de diarrea crónica49. Estos son quizá los más utilizados en la práctica clínica como biomarcadores de inclusión. En la experiencia de los autores, estos biomarcadores no deben reemplazar los criterios diagnósticos de Roma, pero son de utilidad cuando el paciente necesita obtener un resultado objetivo de una prueba para convencerse de su diagnóstico.
Los biomarcadores fecales son también una herramienta diagnóstica no invasiva en el estudio de las alteraciones gastrointestinales. Una de sus ventajas más relevantes es su rendimiento para detectar actividad inflamatoria en la mucosa intestinal, y desempeñan un papel importante para distinguir SII de otras enfermedades orgánicas, como enfermedad inflamatoria intestinal37. Ejemplo de lo anterior es la calprotectina fecal, la cual es el parámetro más estudiado para evaluar inflamación intestinal42, con una sensibilidad del 93% y una especificidad del 94% para distinguir entre SII y enfermedad inflamatoria intestinal, cuando se consideran 50 μg/g de materia fecal como punto de corte50,51. Por lo tanto, un resultado negativo de calprotectina fecal descartaría la presencia de enfermedad inflamatoria intestinal en un paciente con sospecha de SII, y esto reduciría la necesidad de estudios invasivos o más costosos, como la colonoscopia.
Otro biomarcador importante que conviene mucho evaluar en los pacientes con SII-D son los ácidos biliares en heces, para la malabsorción de ácidos biliares52. En condiciones fisiológicas, los ácidos biliares se reabsorben en el íleon y regresan al hígado a través de la circulación enterohepática52. Cuando este proceso se interrumpe, los ácidos biliares pueden estimular la motilidad colónica, la secreción y la permeabilidad intestinal, lo que lleva a diarrea52. Ciertos estudios indican que la malabsorción de ácidos biliares representa el 30% de los casos de SII-D53,54. El estándar de referencia para el diagnóstico de malabsorción de ácidos biliares es la retención de ácido homotaurocólico con selenio-75 (75Se-HCAT); sin embargo, esta prueba no está disponible en México55. Así mismo, suele emplearse la medición de ácidos biliares en heces de 48 horas, pero el costo de la prueba puede ascender hasta $825 dólares y debe ser enviada al extranjero para su medición55. Por lo anterior, los niveles séricos de 7αC4 (metabolito resultante de la 7α-hidroxilasa, enzima limitante de la síntesis de ácidos biliares) han tenido resultados favorables en el tamizaje de malabsorción de ácidos biliares, además de que representa un ahorro de hasta el 50% para el paciente, según la experiencia en México de nuestro grupo55. Aunque la malabsorción de ácidos biliares no sea la causa exclusiva de SII-D, el estudio de esta condición representa una estrategia importante de diagnóstico y tratamiento para aquellos pacientes con SII-D que puedan beneficiarse del tratamiento con secuestradores de ácidos biliares56.
El estudio de los ácidos grasos de cadena corta ha emergido como una alternativa prometedora en las alteraciones de la microbiota intestinal en pacientes con SII57. Estos incluyen el acetato, el propionato y el butirato, metabolitos derivados de la fermentación microbiana del tracto gastrointestinal, y sus niveles pueden estar relacionados con la modulación de la inflamación intestinal57. Farup et al.58 describieron las alteraciones en los niveles de butirato y propionato en pacientes con SII en comparación con controles, con una sensibilidad del 92% y una especificidad del 72%, con un punto de corte > 0.015 mmol/l; así, un aumento en la diferencia propionato-butirato podría reflejar disbiosis o alteraciones en la fermentación bacteriana en los pacientes con SII. Otros estudios han evaluado la utilidad clínica de la combinación de marcadores en heces y en sangre para evaluar el diagnóstico de SII, lo cual va mas allá del alcance de esta revisión59.
La investigación de nuevos biomarcadores para el SII es intensa. El análisis del metaboloma fecal ha emergido como una herramienta prometedora en la identificación de biomarcadores para el SII, destacando entre ellos la cromogranina A y la secretogranina III60,61. Otra línea de investigación con hallazgos alentadores es la volatómica, centrada en compuestos orgánicos volátiles, metabolitos de bajo peso molecular y alta volatilidad62. El estudio del microbioma también ha cobrado relevancia al identificar patrones alterados, como un aumento de Firmicutes y una disminución de Bacteroides, en pacientes con SII63–65. Asimismo, los micro-ARN (miARN) han surgido como biomarcadores potenciales, por su rol regulador en la expresión génica; por ejemplo, el miARN-24 reduce la expresión del transportador de serotonina, lo que se relaciona con una mayor gravedad de los síntomas del SII66.
Dado que aún no se ha identificado un biomarcador único para el SII, el diagnóstico basado en síntomas mediante los criterios de Roma IV continúa siendo fundamental. A pesar de lo anterior, la integración de datos metabolómicos, microbianos, inmunológicos y genéticos representa una vía prometedora hacia una medicina más personalizada. La validación de estos biomarcadores en diversas poblaciones y su incorporación a la práctica clínica facilitarán diagnósticos más precisos, mejor seguimiento y estrategias terapéuticas más efectivas para los pacientes con SII.
Algoritmo diagnóstico y perfil clínico multidimensional
Dado que no existe un biomarcador ni una prueba específica para confirmar o descartar el diagnóstico de SII, las directrices de Roma IV describen que el diagnóstico de SII requiere un enfoque meticuloso, pruebas diagnósticas limitadas y un seguimiento minucioso29. Para ello, la Fundación de Roma ha creado los algoritmos diagnósticos para síntomas gastrointestinales67, que proveen un método práctico, eficiente y costo-efectivo para diagnosticar síntomas gastrointestinales comunes. Estos algoritmos inician con los síntomas gastrointestinales; por ejemplo, en el SII, se refiere al dolor abdominal recurrente asociado con cambios del hábito intestinal, seguido por las pruebas diagnósticas necesarias y finalizando con el diagnóstico de SII y los subtipos de este. Esta información constituye la primera parte en la decisión del clínico para establecer el diagnóstico de un TIIC. La figura 2 muestra el algoritmo diagnóstico para el SII.
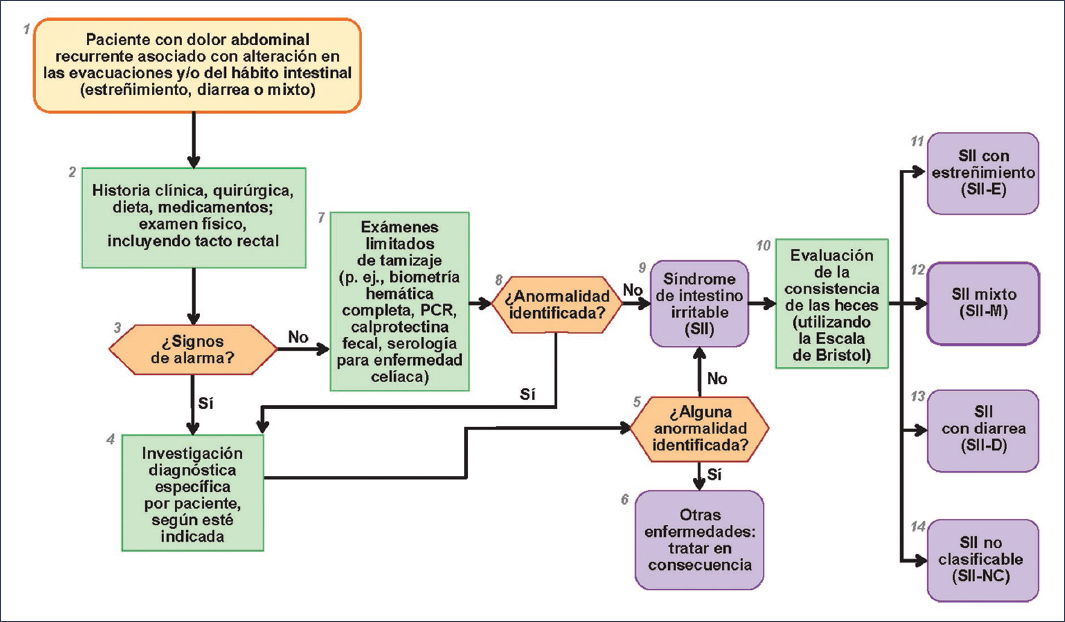
Figura 2. Algoritmo de diagnóstico de Roma IV para pacientes con dolor abdominal recurrente asociado con alteraciones en las evacuaciones o en el hábito intestinal. PCR: proteína C reactiva.
La segunda parte es el manejo terapéutico del SII. Si bien los criterios de Roma IV constituyen una base sólida para llegar a un diagnóstico consistente de SII, por sí solos no abarcan todas las dimensiones del estado clínico del paciente, y por ello la Fundación Roma desarrolló el PCMD, el cual captura todas las dimensiones o manifestaciones de los pacientes con TIIC, permitiendo así establecer un tratamiento individualizado para cada caso68. El PCMD incluye cinco categorías con enfoque en el SII:
- – Diagnóstico categórico: criterios de Roma IV para SII.
- – Modificadores clínicos: subtipo de SII (SII-E, SII-D, SII-M, SII-NC y SII-PI), sensibilidad a FODMAP (oligo-, di- y monosacáridos, y polioles fermentables), sensibilidad al gluten y presencia de distensión abdominal subjetiva u objetiva o visible.
- – Autopercepción de gravedad o impacto en la vida diaria: leve, moderado o grave de acuerdo con la pregunta «¿qué tanto afecta el trastorno a su vida diaria?».
- – Modificadores psicosociales: pueden ser categóricos (según el Manual Diagnóstico y Estadístico de Trastornos Mentales, 5ª edición), dimensionales (Escala de Ansiedad o Depresión Hospitalaria [HAD], signos de alarma psicológicos como ansiedad o depresión) o reportados por el paciente (historia de abuso físico o sexual).
- – Modificadores fisiológicos y biomarcadores de relevancia clínica: se refieren a parámetros fisiológicos o bioquímicos que tienen relevancia clínica porque mejoran la comprensión del diagnóstico o tienen implicación en el manejo de los pacientes (p. ej., manometría anorrectal; estudios de tránsito colónico; sensibilidad visceral por baróstato; evidencia de inflamación por bioquímica, histología, calprotectina fecal citocinas, mRNA o serología para enfermedad celíaca; autoinmunidad como anti-CdtB y antivinculina; otras técnicas, como pruebas para detectar malabsorción de ácidos biliares, permeabilidad intestinal, triptasa fecal y microbiota intestinal). Es de anotar que, en el SII, la aplicación de biomarcadores es muy limitada, como ya se mencionó.
Veamos un ejemplo de la aplicación del PCMD en un caso clínico de SII. Se trata de una mujer de 32 años, soltera, empleada de un bufete de contadores, que consultó por presencia de diarrea de 2 años de evolución, la cual se acompaña de dolor abdominal, meteorismo y flatulencias ocasionales. Los síntomas han sido intermitentes, pero señala que en el último año se hicieron más frecuentes y con mayor interferencia en su calidad de vida. Ella reporta dolor abdominal al menos 3 días a la semana, que se exacerba con el estrés del trabajo, especialmente cuando tienen que finalizar declaraciones de renta. El dolor se alivia con las evacuaciones y en algunas ocasiones se acompaña de distensión abdominal subjetiva. Además, menciona que al menos el 50% de sus evacuaciones son anormales y corresponden a heces líquidas, y que en ocasiones cursa con urgencia defecatoria. Además, la paciente menciona que, en los últimos meses, ha notado dificultad para concentrarse, sensación de «mente nublada» o lentitud mental, que describe como frustrantes y que a veces interfieren con su desempeño laboral. Estos episodios tienden a coincidir con los días de mayor malestar digestivo. La paciente refiere que estos síntomas han afectado las actividades en su vida diaria de manera moderada. Además, a la interrogación dirigida menciona que desde hace 1 año inició con mayor estrés, ya que ha comenzado la preparación de su boda. Su puntuación en la escala de HAD fue de 11 para ansiedad y 5 para depresión. Estudios de laboratorio previos, como perfil tiroideo, serología celiaca, calprotectina fecal y antígenos para Giardia, fueron negativos. La endoscopia y la colonoscopia con biopsia fueron normales, sin datos de malabsorción intestinal ni colitis microscópica. En la exploración física se encuentran los signos vitales dentro de los rangos normales, índice de masa corporal de 22.1 kg/m2 y dolor a la palpación abdominal, sin irritación peritoneal ni masas. No existen datos de alarma ni antecedentes familiares de enfermedad inflamatoria intestinal, enfermedad celiaca o cáncer de colon. Se solicita determinación de 7αC4, la cual resulta positiva. Los hallazgos clínicos son concordantes con SII-D de acuerdo con los criterios de Roma IV en una paciente joven, sin datos de alarma ni antecedentes familiares relevantes, y con estudios negativos para causas orgánicas. La evolución clínica, junto con la exclusión de otras etiologías como enfermedad celiaca, colitis microscópica, infecciones parasitarias y enfermedad inflamatoria intestinal, respaldan esta sospecha inicial. Así mismo, el resultado positivo de 7αC4 sugiere la presencia de malabsorción de ácidos biliares, un trastorno funcional que subyace al SII-D hasta en un 30% de estos pacientes53. En conjunto, el cuadro clínico, la afectación de la calidad de vida y la prueba positiva de 7αC4 orientan al diagnóstico de SII-D secundario a malabsorción de ácidos biliares. La explicación de las categorías del PCMD para este caso se presentan en la tabla 3. El PCMD nos permite categorizar a esta paciente con SII-D con distensión subjetiva y urgencia para evacuar, moderado, con ansiedad y estrés emocional, y malabsorción de ácidos biliares dada por 7αC4. Si bien la presente revisión no tiene por objetivo abordar el tratamiento del SII, debemos mencionar que en este caso se recomendaría iniciar tratamiento empírico con secuestradores de ácidos biliares, como colestiramina o colesevelam, y realizar seguimiento de la respuesta clínica. También se sugiere vigilancia de los síntomas psicológicos y el impacto emocional, dada la frecuente interacción de los síntomas gastrointestinales y el estado psicosocial de estos pacientes.
Tabla 3. Ejemplo de caso clínico y aplicación del perfil clínico multidimensional
| Categoría | Explicación del caso clínico |
|---|---|
| Categoría A: diagnóstico categórico | La paciente cumple con los criterios de Roma IV para SII, pues presenta dolor abdominal al menos una vez por semana relacionado con la defecación y con cambios en la apariencia de las heces, con una duración de los síntomas > 6 meses |
| Categoría B: modificadores clínicos | SII-D, dado que más del 25% de las evacuaciones son de tipo líquidas y menos del 25% son duras, según la escala de Bristol. Además, la paciente reporta síntomas adicionales, como distensión abdominal subjetiva, meteorismo, flatulencias y urgencia defecatoria ocasional, que aunque no forman parte de los criterios diagnósticos son relevantes para el abordaje clínico y terapéutico |
| Categoría C: impacto personal | La paciente respondió «moderadamente» a la pregunta «En general, ¿en qué medida interfieren sus síntomas con sus actividades (trabajo, escuela, actividades sociales, autocuidado, concentración y rendimiento)?». Este nivel de impacto debe considerarse al decidir la intensidad del tratamiento y la necesidad de un abordaje integral |
| Categoría D: modificadores psicosociales | Ansiedad clínica y estrés emocional asociados a múltiples factores estresantes. El estrés de la planeación de su boda parece ser un factor desencadenante y perpetuador de sus síntomas en el contexto del eje intestino-cerebro. Estos factores son relevantes para el diseño de estrategias terapéuticas que incluyan componentes psicoeducativos o intervenciones psicoterapéuticas |
| Categoría E: modificadores fisiológicos y biomarcadores | 7αC4 positivo: indica malabsorción de ácidos biliares. Este hallazgo permite una estratificación más precisa de acuerdo con la fisiopatología y una oportunidad terapéutica específica mediante el uso de secuestradores de ácidos biliares |
|
D: diarrea; SII: síndrome de intestino irritable. |
|
Conclusiones
El diagnóstico del SII se basa fundamentalmente en los criterios de Roma IV, los cuales permiten identificar a los pacientes a partir de síntomas cardinales, como dolor abdominal recurrente asociado a cambios en el hábito intestinal y en la consistencia de las evacuaciones. Estos criterios fueron creados para estandarizar a los pacientes que se incluyen en un estudio de investigación, ya sea epidemiológico o un ensayo clínico. Deben utilizarse en la clínica como guía para el diagnóstico, pero para este efecto se han propuesto los criterios clínicos, que utilizando la base característica de los criterios de Roma IV, si el médico está convencido del diagnóstico por los estudios previos, reducen el marco de tiempo. Por otra parte, la Fundación Roma ha elaborado unos algoritmos diagnósticos que ayudan a dirigir el estudio de los pacientes con diversos TIIC. Finalmente, basándose en todas las dimensiones que pueden acompañar a los TII, el PCMD permite una caracterización completa del paciente, facilitando la elección de estrategias terapéuticas personalizadas y optimizando los resultados a largo plazo. En este contexto, el desarrollo de biomarcadores podrá ayudar en el futuro a una mejor caracterización de los pacientes. Aunque los biomarcadores aún no reemplazan a los criterios clínicos (Roma IV), su validación e incorporación progresiva a la práctica médica podría transformar el abordaje diagnóstico y terapéutico del SII.
Financiamiento
Este trabajo ha sido financiado en parte por la División de Investigación de la Facultad de Medicina de la Universidad Nacional Autónoma de México. G. Mendoza-Domínguez recibe una beca de posgrado por parte de la SECIHTI, con número de CVU: 2094907. A.S. Morales-Guzmán recibe una beca de posgrado por parte de la SECIHTI, con número de CVU: 1141922.
Conflicto de intereses
C.L. Cruz-Rico, G. Mendoza-Domínguez, S.A. Zaragoza-Galicia y A.S. Morales-Guzmán no tienen nada que declarar. M.J. Schmulson: Consejo Asesor de Daewoong Corea del Sur, Gemelli Biotech Inc, Moksha 8 México, Pro.Med.CS. Praga a.s.; ponente para Alfa Sigma México, Armstrong México, Carnot, Daewoong Corea del Sur, Ferrer México/Centroamérica, Medix México, Megalabs, Moksha 8 México, Ecuador, Tecnofarma Colombia/Bolivia; materiales educativos para Moksha 8 México.
Consideraciones éticas
Protección de personas y animales. Los autores declaran que para esta revisión no se han realizado experimentos en seres humanos ni en animales.
Confidencialidad, consentimiento informado y aprobación ética. La revisión no involucra datos personales de pacientes ni requiere aprobación ética. No se aplican las guías SAGER.
Declaración sobre el uso de inteligencia artificial. Los autores declaran que utilizaron inteligencia artificial para la redacción de este manuscrito. Se utilizó ChatGPT para la elaboración del resumen a fin de cumplir con el límite de palabras establecido, así como para asistencia en la redacción y la corrección del estilo en el apartado de biomarcadores y pruebas diagnósticas. Todo esto fue revisado cuidadosamente por los autores. No se empleó inteligencia artificial para la recopilación de datos, el análisis ni la generación de figuras.
