Introducción
La enfermedad por reflujo gastroesofágico (ERGE) se define como una condición que se desarrolla cuando el reflujo del contenido gastroduodenal hacia el esófago provoca síntomas molestos o complicaciones. El término «molestos» hace referencia a aquellos síntomas que interfieren con el bienestar del paciente y afectan negativamente su calidad de vida1. Esta definición reconoce que la ERGE no se limita a la presencia de lesiones endoscópicas (ERGE erosiva), sino que también puede manifestarse como ERGE no erosiva o con síntomas extraesofágicos (tos crónica, laringitis, asma o dolor torácico no cardiaco). Además, contempla la posibilidad de complicaciones a largo plazo, como estenosis esofágica o esófago de Barrett, resaltando que el diagnóstico puede basarse tanto en la clínica como en la confirmación objetiva mediante pruebas funcionales o endoscópicas.
La definición más moderna, es la que propone el Consenso de Lyon 2.0 (2022), que introduce el concepto de ERGE «accionable» (actionable GERD), es decir, aquella en la que existe evidencia objetiva suficiente para justificar una intervención terapéutica dirigida, como una exposición ácida esofágica > 6% del tiempo total en la pH-metría o la pH-metría con impedancia, esofagitis erosiva grave (Los Ángeles C/D), estenosis péptica o esófago de Barrett. Cuando los hallazgos se sitúan en un rango intermedio (4-6% de exposición ácida), el diagnóstico requiere correlacionarlos con otros marcadores, como la asociación síntoma-reflujo, el número de episodios de reflujo o la impedancia basal esofágica. Este enfoque no solo clasifica la ERGE en erosiva, no erosiva o con manifestaciones extraesofágicas, sino que también orienta de manera más precisa cuándo iniciar, intensificar o incluso replantear el tratamiento, optimizando la toma de decisiones clínicas1,2.
Es primordial contar con una definición de consenso global para la enfermedad, ya que puede facilitar su manejo y permitir la investigación colaborativa, para ayudar tanto a los pacientes como a los médicos y las agencias reguladoras.
Epidemiología
Global
La prevalencia real de la ERGE es difícil de estimar, ya que en general se reporta la prevalencia de los síntomas indicativos y no de la enfermedad plenamente demostrada, además de que dependerá de los criterios utilizados para su diagnóstico. Una revisión sistemática con metaanálisis sobre la prevalencia y los factores de riesgo de la ERGE estimó una prevalencia global combinada del 13.98%, con marcada variabilidad entre regiones y países. Las cifras oscilaron desde un 4.16% en China hasta un 22.40% en Turquía, y en nuestro entorno, desde un 12.88% en América Latina y el Caribe hasta un 19.55% en Norteamérica3. Basándose en estos datos, se calcula que aproximadamente 1030 millones de personas en todo el mundo padecen ERGE (Fig. 1).
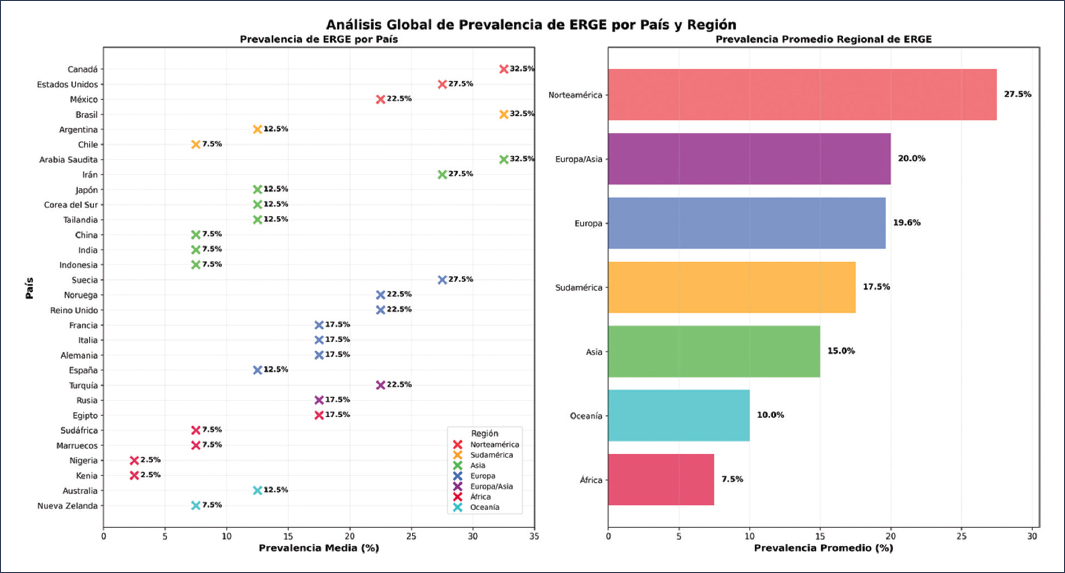
Figura 1. Análisis global de prevalencia de ERGE por país y región.
En otro metaanálisis que incluyó 102 estudios poblacionales con 460,984 participantes de varios países se reveló una marcada variabilidad geográfica en la prevalencia de síntomas de reflujo gastroesofágico, oscilando desde el 2.5% en China hasta el 51.2% en Grecia. Utilizando criterios estandarizados de frecuencia semanal de pirosis o regurgitación, la prevalencia global agrupada fue del 13.3% (intervalo de confianza del 95% [IC 95%]: 12.0-14.6). El análisis identificó factores de riesgo significativos, pero modestos, incluyendo la edad ≥ 50 años (razón de momios [RM]: 1.32), el tabaquismo (RM: 1.26), el uso de aspirina u otros antiinflamatorios no esteroideos (RM: 1.44) y la obesidad (RM: 1.73), siendo con esta última la asociación más fuerte4.
En relación con el sexo, se han reportado leves diferencias en la prevalencia: 16.7% en las mujeres y 15.4% en los hombres4. Sin embargo, diferentes estudios han reportado que la enfermedad por reflujo de tipo erosivo predomina en los hombres, con una proporción de 1.5:1, comparado con el fenotipo no erosivo, el cual predomina en las mujeres. Lo anterior se asocia con el papel que desempeñan las hormonas esteroideas como moduladoras del sistema inmunitario, ya que el estrógeno presenta actividad antiinflamatoria al reducir la migración, la adhesión y la producción de mediadores químicos5. Se ha demostrado que el estrógeno atenúa la esofagitis por reflujo mediante la inactivación de los mastocitos al inhibir la producción de citocinas, que se encuentran principalmente involucrados en el inicio del daño tisular inducido por la esofagitis por reflujo. También se reveló que el estrógeno suprimió significativamente el nivel de factor inhibidor de macrófagos tisulares en el esófago, el cual regula la inflamación y la respuesta inmunitaria innata implicada en la infiltración de macrófagos y la producción de factor de necrosis tumoral alfa5.
Al comparar otros aspectos, como el económico, se reporta una mayor frecuencia de síntomas de la enfermedad en clases sociales consideradas media-alta y alta. Cuando se contempla la ocupación de la persona, es más frecuente en profesionistas en comparación con amas de casa, estudiantes, desempleados y jubilados. En relación con la escolaridad, se notó un incremento gradual conforme esta avanza, afectando principalmente a sujetos con estudios universitarios2.
Otra manera de reportar el incremento real de los casos de ERGE en el mundo puede ser mediante el aumento de los casos de complicaciones de esta, en especial del adenocarcinoma del esófago. Por ejemplo, el número de casos nuevos reportados de esófago de Barrett se documentó en diferentes estudios en 11 por cada 100,000 pacientes en la década de 1990 y hasta 23 por cada 100,000 pacientes en la década de 2000. En el caso del adenocarcinoma de esófago, se reportó un aumento del doble en la incidencia de 1976 a 1987 y un incremento de hasta siete veces en 20105.
México
La caracterización epidemiológica de la ERGE en México se ha sustentado en varios estudios relevantes. López-Colombo et al.6 evaluaron a 500 personas de la población general en Tlaxcala utilizando el cuestionario Roma II, y encontraron pirosis en el 19.6% (IC 95%: 16.2-23.4). Posteriormente, Schmulson7 estudió a 40 pacientes atendidos en una consulta privada en la Ciudad de México, aplicando el mismo cuestionario y complementando la evaluación con endoscopia en 36 casos y pH-metría esofágica con cápsula Bravo en los restantes. La media de edad fue de 44.5 ± 2.5 años, predominando las mujeres (62.5%) y con un índice de masa corporal promedio de 25.5 ± 0.8 kg/m². La pirosis se reportó en el 40% de los participantes, confirmándose ERGE por endoscopia en el 62.5% de ellos, mientras que, entre los asintomáticos según el cuestionario, la endoscopia y la pH-metría detectaron la enfermedad en el 29.2%. Un tercer estudio, realizado por Peralta-Pedrero et al.8, aplicó el cuestionario de Carlsson-Dent a 400 adultos mayores de 60 años en el primer nivel de atención institucional, y se identificó ERGE en el 25% (IC 95%: 21-29).
Años después, el estudio de mayor alcance en el país, la encuesta nacional SIGAME, evaluó a población abierta (cerca de 4000 sujetos de toda la República Mexicana) aplicando los criterios de Roma III9. Los resultados mostraron que la pirosis o la regurgitación se presentaban diariamente en el 1.2% de la población, al menos una vez por semana en el 12.1% y al menos una vez al mes en el 49.1%, confirmando que la ERGE es altamente prevalente en México. La pirosis fue más común en las mañanas (62%), con intensidad muy leve o leve en el 45.3% de los casos. La regurgitación, también reportada principalmente en la mañana (52.3%), presentó intensidad muy leve o leve en el 73.6%. Entre los síntomas asociados, considerando su aparición en al menos un día por semana, la náusea fue el más frecuente (16.9%), seguida por dolor torácico (15.3%) y vómito (4.05%).
Con respecto a la variabilidad geográfica, aun dentro de nuestro país, hay diferencias según la zona, reportándose mayor frecuencia de síntomas en el centro-sur y el oeste, en comparación con la menor frecuencia en el centro-norte y el noreste9 (Fig. 2).
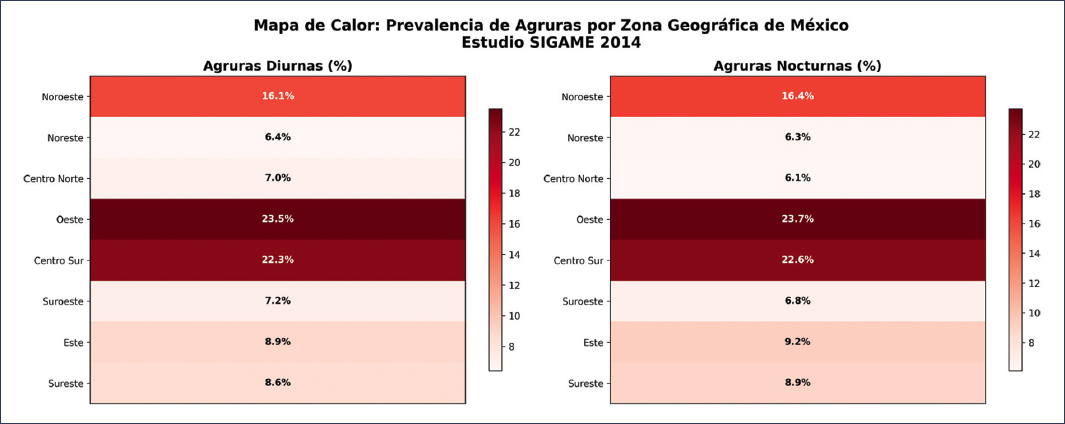
Figura 2. Mapa de calor: Prevalencia de agruras por zona geográfica de México. Estudio SIGAME 2014.
Además de la diferencia observada en la prevalencia según la región, de igual manera se observan diferencias tanto según la edad como según el sexo. Los sujetos mayores de 50 años reportan una prevalencia del 17.3% y los menores de 50 años del 14%10. El estudio SIGAME confirma en nuestro país que los individuos con síntomas de la enfermedad contaban con mayor edad que aquellos sin la enfermedad (edad promedio 42.6 años vs. 37.8 años; p = 0.0001)9. Los mecanismos que explican el aumento de la prevalencia conforme avanza la edad son las alteraciones en la motilidad esofágica, la disminución de la secreción de saliva y bicarbonato, la reducción de la presión del esfínter esofágico inferior (EEI), la debilidad diafragmática y el aumento de la incidencia de hernia hiatal, la presencia de comorbilidad y el uso concomitante de fármacos como nitratos, anticolinérgicos, antagonistas del calcio, benzodiacepinas y antidepresivos, que pueden disminuir la presión del EEI y aumentar la incidencia de la enfermedad11.
Factores de riesgo
La ERGE una condición multifactorial en la que la interacción de la predisposición individual, los hábitos de vida y la comorbilidad influye en su aparición y gravedad. Entre los factores de riesgo más reconocidos se encuentran la obesidad, el embarazo, el tabaquismo, el consumo excesivo de alcohol, café o comidas grasas, y el uso de fármacos que disminuyen la presión del EEI (Table 1). También se han identificado condiciones anatómicas y funcionales, como la hernia hiatal, el vaciamiento gástrico retardado y las alteraciones en la motilidad esofágica, que facilitan el reflujo de contenido gástrico. Los factores genéticos y el estrés psicológico pueden actuar como moduladores, aumentando la susceptibilidad o la intensidad de los síntomas.
Tabla 1. Factores de riesgo y su relación con la enfermedad por reflujo gastroesofágico
| Factor de riesgo | Mecanismos implicados |
|---|---|
| Obesidad | Disminución de la presión del EEI |
| Incremento de las relajaciones transitorias del EEI | |
| Incremento de la presión intraabdominal | |
| Hernia hiatal | |
| Tabaquismo | Disminución de la presión del EEI |
| Dieta alta en grasas | Disminución de la presión del EEI |
| Retraso del vaciamiento gástrico | |
| Café, té, chocolate | Disminución de la presión del EEI |
| Disminución del pH intraesofágico | |
| Bebidas carbonatadas | Disminución de la presión del EEI |
| Incremento de las relajaciones transitorias del EEI | |
| Disminución del pH intraesofágico | |
| Alcohol | Daño directo a la mucosa esofágica |
| Disfunción del EEI | |
| Trastorno de la motilidad | |
| Helicobacter pylori | Reducción de las complicaciones de la ERGE |
| Disminución de la producción de ácido | |
| Actividad física | El ejercicio de intensidad moderada de manera regular (150 min a la semana) es protector |
| Genética | Tasa de concordancia del 42% en gemelos monocigóticos frente al 26% en gemelos dicigóticos |
| Disbiosis | Proteobacteria, Firmicutes, Bacteroidetes, Fusobacteria y Actinobacteria tienen mayor relevancia para los trastornos esofágicos |
|
EEI: esfínter esofágico inferior; ERGE: enfermedad por reflujo gastroesofágico. |
|
Obesidad
Entre los factores de riesgo con mayor impacto se encuentra la obesidad, ya que se ha documentado un aumento en la prevalencia de la enfermedad de hasta el 22.1% (RM: 1.73) en comparación con sujetos sin obesidad, con una prevalencia del 14.2%4. Sin embargo, se considera que la circunferencia de la cintura, así como la relación cintura-cadera, tienen mejor correlación con los síntomas de la enfermedad y sus complicaciones (esofagitis erosiva, esófago de Barret y adenocarcinoma de esófago) que el índice de masa corporal. Los reportes relacionan la adiposidad central con un riesgo de esofagitis erosiva de 1.87, de esófago de Barrett de 1.98 y de adenocarcinoma de esófago de 2.5112.
Se han descrito numerosos mecanismos por los cuales los individuos con obesidad presentan una mayor exposición al ácido, entre los cuales destacan un EEI hipotenso, un aumento de las relajaciones transitorias del EEI y un aumento de la presión intraabdominal con desarrollo de hernia hiatal12. La vía comúnmente sugerida es que el aumento de la presión abdominal relaja el EEI, exponiendo a la mucosa esofágica al contenido gástrico. Esto se asocia a que la grasa visceral es metabólicamente activa, y se relaciona con los niveles séricos de adipocinas como la interleucina 6 y el factor de necrosis tumoral alfa, influyendo en la enfermedad y sus complicaciones, como la carcinogénesis13.
Los resultados del monitoreo de pH de 24 horas han demostrado que la obesidad se asocia con un aumento significativo del número tanto de episodios de reflujo como de episodios de larga duración, especialmente durante el periodo posprandial12. De igual manera, el monitoreo mediante pH-metría con impedancia reporta no solo un incremento de los episodios de reflujo ácido, sino también de los episodios de reflujo no ácido. Por medio de manometría esofágica de alta resolución se han evaluado la morfología y la función de la unión esofagogástrica, y se ha reportado una clara correlación entre las alteraciones en los gradientes de presión tanto intragástrica como gastroesofágica y la circunferencia de la cintura, lo cual promueve el flujo retrógrado del contenido gástrico al esófago12. Otro hallazgo fue la correlación del índice de masa corporal y de la circunferencia de la cintura con la separación axial del EEI y la crura diafragmática debido al aumento de la presión intragástrica12,13. Esto es relevante, ya que la presencia de hernia hiatal tiene implicaciones fisiopatológicas en la patogénesis de la enfermedad, como reducción de la presión del EEI, alteración del aclaramiento ácido esofágico y mayor sensibilidad a las relajaciones transitorias del EEI por distensión.
Tabaquismo
En relación con el tabaquismo, en los fumadores se reporta una prevalencia de ERGE del 19.6% (RM: 1.26) frente al 15.9% en no fumadores3, y se describe que incluso existe una disminución de hasta tres veces en los síntomas de regurgitación y pirosis al suspender dicho hábito. Además, se ha documentado que la duración del tabaquismo se relaciona con alteraciones de la motilidad esofágica y del vaciamiento14; esto se debe a que el tabaco reduce la presión en reposo del EEI. Los estudios han demostrado que en sujetos sanos el tabaco redujo la presión del EEI en un 37% en 2-3 minutos, mientras que aspirar un cigarrillo apagado no indujo ningún cambio en la presión del EEI15. La presión del esfínter se mantuvo baja hasta que se dejó de fumar y luego volvió a la normalidad. Otro estudio obtuvo resultados similares al observar que fumar cigarrillos provocó una disminución de la presión del EEI del 41% en 1-4 minutos16, y regresó a la normalidad en 3-8 minutos después de dejar de fumar16. De igual manera, se reportó que las mediciones de pH también mostraron un aumento del reflujo durante y después de fumar. El mecanismo probable por el cual se reduce la presión del EEI es el bloqueo de los receptores colinérgicos por la nicotina y la consiguiente relajación de las fibras musculares circulares. El consumo de cigarrillos también se asoció con un tiempo prolongado de aclaramiento ácido, a causa de una disminución en la secreción salival y una menor concentración de bicarbonato14.
Dieta
La dieta, en especial un consumo elevado de grasas, azúcar, chocolate y sal, así como una disminución en el consumo de frutas y verduras, se han asociado a la enfermedad, pero la evidencia es contradictoria. Algunos estudios reportan un incremento de los síntomas con el consumo de una dieta alta en grasas y una reducción con una dieta alta en fibra. Por el contrario, en estudios realizados en gemelos monocigóticos no se relacionan con la enfermedad17.
La relación entre la ingesta de grasas y la ERGE se ha atribuido a la disminución de la presión basal del EEI al consumir dichos alimentos. Sin embargo, se conoce que las comidas ricas en grasas liberan altas cantidades de colecistocinina, la cual retrasa el vaciamiento gástrico al reducir las contracciones antrales, aumentando la presión pilórica y la relajación del fondo gástrico, dando como resultando distensión gástrica, desencadenante de las relajaciones transitorias del EEI18.
El consumo de una dieta alta en fibra se ha asociado inversamente con el riesgo de síntomas de la enfermedad. Los estudios han demostrado que el consumo de pan con alto contenido de fibra dietética reduce el riesgo de reflujo a la mitad, comparado con el consumo de pan blanco con bajo contenido de fibra19,20. Una explicación de esto es que la fibra dietética elimina los nitritos en el estómago, lo cual reduciría la formación de óxido nítrico y, por consiguiente, la relajación del EEI. Una dieta mediterránea, la cual se caracteriza por un alto consumo de frutas, verduras, legumbres, cereales integrales, pescado y aceite de oliva, así como un consumo moderado de alcohol y lácteos, y bajas cantidades de carnes rojas y productos procesados, se relaciona con una disminución en la frecuencia de los síntomas de reflujo19.
El consumo de café y té se ha relacionado con la frecuencia de los síntomas; sin embargo, no se conoce por completo el mecanismo involucrado. Los estudios con sujetos sanos han demostrado que la administración intragástrica de estas sustancias provoca una disminución significativa de la presión del EEI y del pH en el esófago inferior, cambios no observados con el café descafeinado18. No obstante, una revisión sistemática muestra que la evidencia es particularmente contradictoria, ya que varios trabajos no encontraron un mayor riesgo de síntomas de reflujo en consumidores de café21. En relación con las bebidas carbonatadas, estas disminuyen la presión del EEI e incrementan el número de relajaciones transitorias18. De igual manera, se ha documentado que causan reducción a corto plazo del pH intraesofágico y aumentan la secreción ácida gástrica10.
El consumo de alcohol es un claro factor asociado a ERGE, ya que se reporta un aumento de síntomas en hasta un 20.3%, comparado con el 18.1% en no consumidores3. Entre los mecanismos se encuentran un daño directo tanto a la mucosa esofágica como a la función del esófago, causando disfunción del EEI, peristalsis anormal y trastornos de la motilidad. El alcohol puede aumentar la agresividad del contenido gástrico refluido al influir en la secreción ácida gástrica, aunque depende del tipo de alcohol administrado. Por ejemplo, el etanol puro no estimula la secreción de gastrina, y en cambio la cerveza y el vino sí18. En un estudio con sujetos sanos sin ERGE, el vino blanco se asoció tanto a una reducción de la presión del EEI como a un incremento del tiempo con un pH esofágico < 4, pero no así el vino tinto, el cual sí indujo síntomas de la enfermedad, pero no incrementó el tiempo con pH < 4 a pesar de contar con más porcentaje de alcohol que el vino blanco (12% vs. 8%)22. Estos hallazgos sugieren que otros ingredientes, en lugar del alcohol, promueven el reflujo entre los consumidores de estas bebidas alcohólicas14. Sin embargo, otros estudios reportan una relación inversa entre el consumo de alcohol y el reflujo, documentando que los sujetos con consumo intenso de alcohol presentan menos prevalencia de síntomas que los no tomadores (49% vs. 56%, respectivamente)23. Entre las hipótesis se menciona que los sujetos con consumo intenso de alcohol presentan menos episodios de pirosis, probablemente secundario a una reducción en la percepción de los síntomas inducida por neuropatía18.
El chocolate es otra sustancia que se ha relacionado con exacerbación de los síntomas de reflujo. Los estudios han concluido que su ingesta reduce significativamente la presión del EEI de 14.6 ± 1.1 a 7.9 ± 1.3 mmHg24. De igual manera, otros estudios han demostrado un aumento significativo de la exposición al ácido durante las primeras horas tras su consumo18.
La capsaicina es el compuesto activo del pimiento rojo y de los alimentos picantes. Su importancia radica en que su receptor vaniloide de potencial transitorio 1 es un mediador de la acidez estomacal. Sin embargo, la exposición del receptor a la capsaicina se caracteriza por su activación, seguida de su desensibilización con la administración crónica. Además, los cambios en la presión del EEI y en el vaciamiento gástrico parecen ser dependientes de la dosis, por lo que los pacientes podrían desarrollar acidez, pero probablemente no inducida por un aumento del reflujo gastroesofágico18.
Algunos otros alimentos también han demostrado asociación con los síntomas de la enfermedad. Por ejemplo, el consumo de comida con gran contenido de sal incrementa el riesgo de reflujo hasta en un 70%, comparado con sujetos que no agregan sal extra a sus alimentos (RM: 1.7); la cebolla incrementa tanto el número de episodios de reflujo como el porcentaje de tiempo con pH < 4, pirosis y eructos durante las primeras 2 horas tras su consumo; la leche regular ocasiona más episodios de pirosis que la leche baja en grasas; y los cítricos se han correlacionado con pirosis, pero se desconoce el mecanismo implicado18.
Ya que muchos síntomas de reflujo ocurren en el periodo posprandial, se han estudiado no solo los alimentos asociados con síntomas de reflujo sino también las prácticas relacionadas con la dieta, como la ingesta rápida de alimentos, los patrones de comidas irregulares e incluso saltarse comidas o comer poco antes de acostarse20. Se ha demostrado que los sujetos con un «ritmo de alimentación moderado a rápido» tienen mayor probabilidad de tener ERGE en comparación con aquellos con un «ritmo de alimentación moderado». De igual manera, la prevalencia de ERGE es mayor en los sujetos con un «patrón de comidas irregular» que en aquellos con un «patrón de comidas regular», y los sujetos con un «intervalo corto entre comidas y sueño» tienen mayor probabilidad de padecer ERGE que aquellos con un «intervalo largo entre comidas y sueño». Otros estudios han reportado que los pacientes que se acuestan en menos de 3 horas posterior a una ingesta de alimento presentan RM de 7.45 para desarrollo de ERGE, comparados con sujetos que se acuestan en más de 4 horas25.
Actividad física
La actividad física aeróbica de intensidad moderada de manera regular se asocia inversamente con los síntomas de la enfermedad26, a diferencia del ejercicio extenuante, el cual se ha asociado de manera positiva con la enfermedad17. Clark et al.27 reportaron que correr se asociaba con una mayor prevalencia de reflujo, mientras que el ciclismo se asociaba con una menor incidencia, lo cual demuestra que los ejercicios aeróbicos de baja intensidad, como caminar, andar en bicicleta y el yoga, pueden ofrecer beneficios protectores. Se ha reportado que las personas que realizan 150 minutos de actividad física por semana presentan una reducción del 72% en el riesgo de desarrollar ERGE26.
Genética
Los factores genéticos se relacionaron por primera vez en la etiología de la ERGE por estudios realizados con gemelos, que reportaron tasas de concordancia significativamente más altas en gemelos monocigóticos, de hasta el 42%, en comparación con el 26% en gemelos dicigóticos, con una heredabilidad estimada del 43%28. El estudio en relación con la genética más exitoso ha sido el estudio de asociación de todo el genoma (GWAS), con un gran tamaño muestral y una característica clave en los estudios exitosos; sin embargo, los GWAS iniciales para la ERGE no identificaron ningún gen de riesgo, pero enfoques más recientes que utilizan una definición amplia del fenotipo para maximizar el tamaño de la muestra lograron identificaron 25 loci de riesgo29. De igual manera, se revelaron fuertes relaciones genéticas entre la enfermedad y diversos rasgos, entre los que destacan la depresión, lo que probablemente refleja el componente psicológico previamente demostrado como asociado, así como la obesidad, hallazgo esperado dado que el sobrepeso es un factor de riesgo importante para la enfermedad29.
En cuanto a las complicaciones de la ERGE, es bien conocida su asociación con el esófago de Barrett y el adenocarcinoma de esófago, en los cuales los estudios familiares observacionales informan que tienen una base genética compartida, ya que el riesgo de las tres enfermedades aumenta cuando un familiar se ve afectado por alguna de ellas. Gharahkhani et al.30 estimaron el grado de trasfondo genético compartido por estas tres enfermedades, reportando una superposición genética significativa del 77% entre la ERGE y el esófago de Barrett, y del 88% entre la ERGE y el adenocarcinoma de esófago. Así mismo, un metaanálisis de GWAS que involucró información de más de 10,000 pacientes identificó nuevos genes de riesgo y vías biológicas que representan mecanismos fisiopatológicos para dichas enfermedades31. Entre las asociaciones más fuertes se encontró la del gen CFTR en el cromosoma 7q31. Dicho gen codifica una proteína de membrana del casete de unión a ATP que funciona como un canal de cloruro y está mutada en la fibrosis quística, enfermedad en la cual hasta el 81% de los pacientes muestran síntomas de reflujo, además de un riesgo incrementado de cáncer de la unión esofagogástrica32.
Disbiosis
En los últimos años se ha aclarado la correlación entre la aparición y la progresión de diversas enfermedades intestinales y la microbiota intestinal. La disbiosis se ha relacionado con el desarrollo de hipersensibilidad visceral, lo cual sugiere la posible participación de la desregulación de la microbiota en la patogénesis de enfermedades relacionadas con la ERGE33. El estudio de la microbiota esofágica tiene el fin de establecer la relación entre la patogénesis, la detección temprana y los enfoques terapéuticos para los trastornos esofágicos. Se ha notado que la composición de la microflora esofágica varía entre esófagos con ERGE y esófagos normales. Algunas diferencias son una mayor colonización por microorganismos gramnegativos, en particular Campylobacter, en la mucosa esofágica de pacientes con ERGE en comparación con individuos sanos28. El grupo de la familia Clostridiales Vadin BB60, el género Lachnospiraceae UCG004, el género Methanobrevibacter y el filo Actinobacteria han mostrado una correlación inversa con la vulnerabilidad a la enfermedad. Asimismo, se consideran contribuyentes a la biosíntesis de ácidos grasos de cadena corta, los cuales no solo sirven como fuente principal de energía para los colonocitos, sino que también desempeñan un papel fundamental en la regulación bidireccional de la motilidad colónica, la preservación de la homeostasis intestinal y la mejora de la integridad de la barrera intestinal. El grupo Clostridiales se ha relacionado con patologías esofágicas como la esofagitis y el esófago de Barrett, ya que influye en los procesos inflamatorios de la mucosa esofágica y contribuye al desarrollo de metaplasia intestinal. Un estudio japonés utilizando reacción en cadena de la polimerasa cuantitativa del gen ARNr 16S reportó que los grupos Proteobacteria, Firmicutes, Bacteroidetes, Fusobacteria y Actinobacteria tienen mayor relevancia para los trastornos esofágicos que los recuentos bacterianos absolutos29. Por otra parte, la clase Mollicutes, el género Anaerostipes y el filo Tenericutes han mostrado asociación con el riesgo de ERGE. Por todo lo anterior, se han estudiado diferentes cepas de probióticos, entre las que Lactobacilli spp. y Bifidobacteria spp. han demostrado eficacia en el alivio de la ERGE33.
Impacto socioeconómico y en la calidad de vida
Debido a su alta prevalencia, la cronicidad de sus síntomas y el efecto en la calidad de vida, el impacto económico de la ERGE suele ser muy elevado. Una cantidad importante de pacientes consumen medicamentos que inhiben la secreción gástrica de ácido, ya sea por indicación del médico o por autoprescripción. A finales de la década de 1990, las estadísticas estadounidenses reportaron un costo directo de la enfermedad de 9.3 billones de dólares, de los que el 63% correspondió a medicamentos, el 27% a hospitalizaciones, el 7% a consultas, el 2% a visitas a domicilio y el 1% a atención en urgencias34. En la década de 2000, las ventas de inhibidores de la bomba de protones llegó a 10 billones de dólares, representando dos de los cinco fármacos más vendidos en el ámbito nacional y el 50.7% de las prescripciones para enfermedades del aparato digestivo, equivalente al 77.3% de los costos totales35. A esto se agregan los costos indirectos, como los días de ausencia por consultas médicas, las citas para realización de estudios y la disminución en la productividad durante la jornada laboral. En conjunto, se calcula un 41% de decremento en la productividad, con un costo promedio de 237.00 dólares en un periodo de 3 meses y un impacto económico de 3441.00 dólares de costo total para la enfermedad, en comparación con sujetos sanos2. En otros países, como el Reino Unido, los gastos estimados tanto de la atención médica como del ausentismo laboral debido a la ERGE se calculan en 760 millones de libras esterlinas, y en Alemania, el costo directo por paciente y año fue de aproximadamente 342 euros36. Además, los pacientes con enfermedad refractaria presenta aún más impacto económico, reportándose diferencias de 26,057 frente a 15,285 dólares por paciente al año. Además, no hay que olvidar los gastos en caso de realizar cirugía antirreflujo, cuyos costos directos de atención médica estimados por paciente fueron de 5170 dólares en atención ambulatoria y de 15,108 dólares en pacientes hospitalizados, acumulándose hasta 29,513 dólares si se requería otro procedimiento quirúrgico37.
La ERGE afecta significativamente la calidad de vida de los sujetos que la padecen. Diferentes cuestionarios reportan una reducción en la calidad de vida similar a la de los pacientes con enfermedades crónicas degenerativas como la diabetes mellitus, la hipertensión arterial o la artritis14. Un porcentaje importante de pacientes tienen que modificar de manera drástica sus hábitos alimenticios, hasta el 60% tienen problemas relacionados con el sueño y el 40% refieren tener dificultad para concentrarse en el trabajo debido a los síntomas. Los indicadores de actividad diaria, dificultad al vestirse, dieta, relaciones personales y manifestaciones psicológicas se han demostrado afectados, todos con significancia estadística, en sujetos que reportan pirosis al menos un día al mes en nuestro país, comparados con sujetos considerados sanos. En todo el mundo, la ERGE fue causa de 3.6 millones de años vividos con discapacidad en la década de 1990, lo cual hace referencia a la frecuencia y las consecuencias no fatales para la salud de una enfermedad que representa el 0.6% de todos los años vividos con discapacidad, lo cual aumentó un 77.19%, que equivale a 6 millones para el año 201738.
Los estudios sobre la calidad de vida de los pacientes con ERGE basados en cuestionarios como el GERD-HRQoL reportan que aproximadamente el 83.3% presentan una calidad de vida deficiente debido a la enfermedad, y solo el 16.7% cuentan con una calidad de vida buena30. El síntoma que suele afectar con más frecuencia es la pirosis, hasta en un 85.9%, tanto después de las comidas como al acostarse. En cambio, los menos reportados son los cambios en la dieta (61%) y las alteraciones del sueño debido a la acidez (44%)39.
Conclusión
La ERGE constituye un problema de salud global, con una prevalencia significativa y marcada variabilidad geográfica, influenciada por factores genéticos, anatómicos, funcionales y de estilo de vida. Su impacto se extiende más allá de la sintomatología, pues afecta de forma importante la calidad de vida, la productividad laboral y los sistemas de salud debido a sus costos directos e indirectos.
El abordaje diagnóstico debe sustentarse en criterios actualizados, como los propuestos por el Consenso de Lyon 2.0, que permiten optimizar la toma de decisiones terapéuticas. El tratamiento requiere un enfoque integral e individualizado que combine modificaciones en el estilo de vida, farmacoterapia y, en casos seleccionados, intervenciones quirúrgicas o terapias emergentes.
La investigación futura debe centrarse en la identificación de subpoblaciones con riesgo diferenciado, en la evaluación de intervenciones innovadoras y en la comprensión del papel de la microbiota y la genética en la fisiopatología de la enfermedad, con el objetivo de mejorar la prevención, el diagnóstico y el tratamiento.
Financiamiento
Los autores declaran no haber recibido financiamiento para este estudio.
Conflicto de intereses
L. Bolio-Lavalle no tiene conflicto de intereses. J.M. Remes-Troche es miembro asesor de Adium, Bicodex, Prometis Pharma y Carnot, y ha sido conferencista para Adium, Alfasigma, Carnot, Menarini Centroamérica y M8.
Consideraciones éticas
Protección de personas y animales. Los autores declaran que para esta investigación no se han realizado experimentos en seres humanos ni en animales.
Confidencialidad, consentimiento informado y aprobación ética. El estudio no involucra datos personales de pacientes ni requiere aprobación ética. No se aplican las guías SAGER.
Declaración sobre el uso de inteligencia artificial. Los autores declaran que no utilizaron ningún tipo de inteligencia artificial generativa para la redacción de este manuscrito.
