Introducción
El síndrome de intestino irritable (SII) es una enfermedad compleja y multifactorial en la que diversos factores externos —como la dieta, las infecciones gastrointestinales y el entorno— interactúan para desencadenar alteraciones fisiológicas en individuos predispuestos. Esta susceptibilidad se ha asociado con factores intrínsecos del paciente, tales como la predisposición genética, la hipersensibilidad visceral, las alteraciones en la percepción del dolor, la disfunción del eje cerebro-intestino, las intolerancias alimentarias y los cambios en la composición de la microbiota intestinal (Fig. 1). Al tratarse de una condición heterogénea, es evidente que muchos de estos factores pueden relacionarse mutuamente. Por ejemplo, se han identificado alteraciones inflamatorias de bajo grado en el epitelio intestinal, posiblemente moduladas por una microbiota específica, la cual a su vez puede verse afectada por cambios dietéticos. Así, el consumo de alimentos que favorecen la producción de gas y metabolitos como el acetato y el sulfuro de hidrógeno puede comprometer la integridad de la barrera epitelial, inducir daño celular directo y provocar cambios inmunohistológicos de bajo grado. Este artículo de revisión se centra en la descripción de los mecanismos fisiopatológicos tradicionales del SII, así como en aquellos que han sido propuestos en los últimos años.
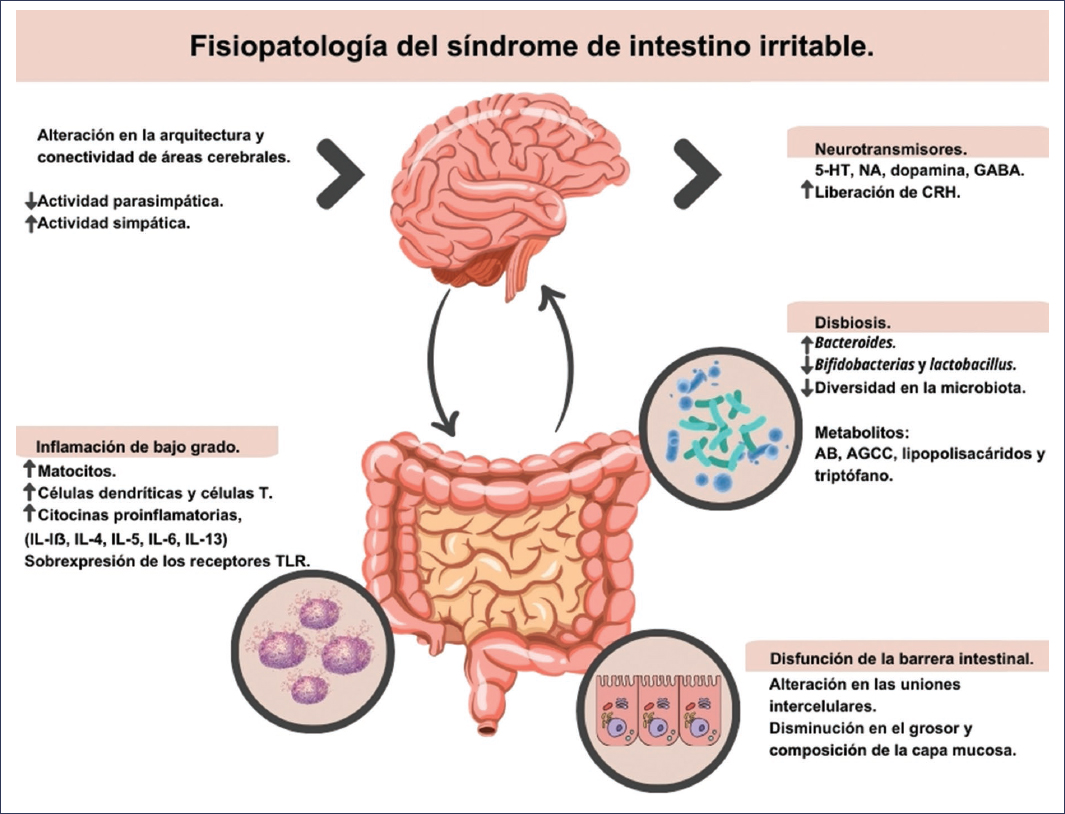
Figura 1. La fisiopatología del síndrome de intestino irritable es multifactorial e involucra una compleja interacción de disfunción del eje microbiota-intestino-cerebro, alteraciones en la motilidad gastrointestinal, hipersensibilidad visceral, disbiosis, disfunción inmunitaria de bajo grado y cambios epigenéticos. AB: ácidos biliares; AGCC: ácidos grasos de cadena corta; CRH: hormona liberadora de corticotropina; GABA: ácido gamma-aminobutírico; 5-HT: serotonina (5-hidroxitriptamina); IL: interleucina; NA: noradrenalina; TLR: receptores tipo Toll.
Hipersensibilidad visceral
De todos los mecanismos fisiopatológicos descritos, la hipersensibilidad se considera el más común y se ha propuesto como un hallazgo característico en el SII, ya que cerca del 60% de los pacientes con SII presentan sensibilidad aumentada del intestino ante diversos estímulos fisiológicos1. La hipersensibilidad visceral conduce a una percepción exacerbada de distensión, dolor abdominal y alteraciones en la motilidad intestinal. Dichas alteraciones no son fijas y suelen fluctuar en el tiempo.
La causa exacta de esta hipersensibilidad visceral permanece desconocida; no obstante, se han propuesto varios mecanismos que implican sensibilización periférica y central. Los mecanismos subyacentes a estas alteraciones incluyen tanto la disregulación de neurotransmisores, como la serotonina, que es clave en la coordinación motora intestinal, como la influencia de mediadores locales producidos por células inmunitarias y mastocitos2.
Las terminaciones nerviosas sensoriales de la mucosa y la submucosa del intestino son las encargadas de detectar estímulos nociceptivos a través de canales iónicos (de calcio, potasio y sodio), canales transitorios de potencial (TRPV1, TRPA1, TRPV4), receptores propioceptivos y receptores acoplados a proteínas G3. La sensibilización de estos canales está modulada principalmente por mediadores como la histamina y la serotonina, que desempeñan un papel clave en la amplificación de las señales de dolor.
Adicionalmente, la activación del receptor activado por proteasas 2, mediante proteasas como la tripsina y la triptasa derivadas de mastocitos, promueve procesos de endocitosis y activa vías de señalización que culminan en el establecimiento de una hipersensibilidad nociceptiva sostenida4.
Las vías de señalización intracelulares mediadas por p38 MAPK y proteína cinasa C tienen un papel crucial en la regulación de la expresión de canales iónicos y receptores en las terminales nerviosas durante la inflamación; estas vías fosforilan proteínas clave, modificando la densidad y la función de canales como los TRP y los canales dependientes de voltaje. Esta fosforilación, a su vez, moviliza los canales desde compartimentos intracelulares a la membrana, lo que incrementa la sensibilidad de las neuronas a los estímulos. Además, la activación de estas vías favorece la expresión de receptores pronociceptivos, que detectan mediadores inflamatorios y perpetúan la excitabilidad del sistema nervioso periférico5.
El «puente» hacia la sensibilización inducida por estrés no se conoce con exactitud. Existe evidencia de que la distensión repetitiva del colon induce un incremento de la actividad motora y promueve la secreción de factor liberador de corticotropina (CRF)6. En consecuencia, estímulos periféricos repetitivos podrían activar hormonas de estrés que pueden estar involucradas en la fisiopatología de sensibilización por estrés. El CRF actúa sobre sitios extrahipotalámicos en el sistema nervioso central (SNC) que regulan la conducta y las respuestas autonómicas. La ansiedad y la depresión también están relacionadas con alteraciones en el eje CRF-hipotálamo; por ejemplo, en roedores, la administración de CRF incrementa la ansiedad y estimula la motilidad, la secreción y la hipersensibilidad colónica7. En los humanos, el CRF induce hipersensibilidad visceral y aumenta la motilidad colónica, mientras que la administración de un antagonista del CRF alivia estas respuestas8.
Alteraciones de la permeabilidad intestinal
La integridad de la barrera intestinal es fundamental para proteger al organismo contra agentes patógenos y evitar respuestas inflamatorias excesivas. En el SII se ha documentado una alteración de esta barrera, en especial de las uniones intercelulares entre enterocitos. Los estudios con microscopía electrónica han revelado separaciones en estas uniones en biopsias de pacientes con SII9. Asimismo, en análisis histológicos de biopsias de colon se ha observado una disminución en la expresión de proteínas clave de las uniones estrechas, como la ocludina, las claudinas 1, 3 y 5, y las proteínas de la zónula occludens9 (Fig. 2).
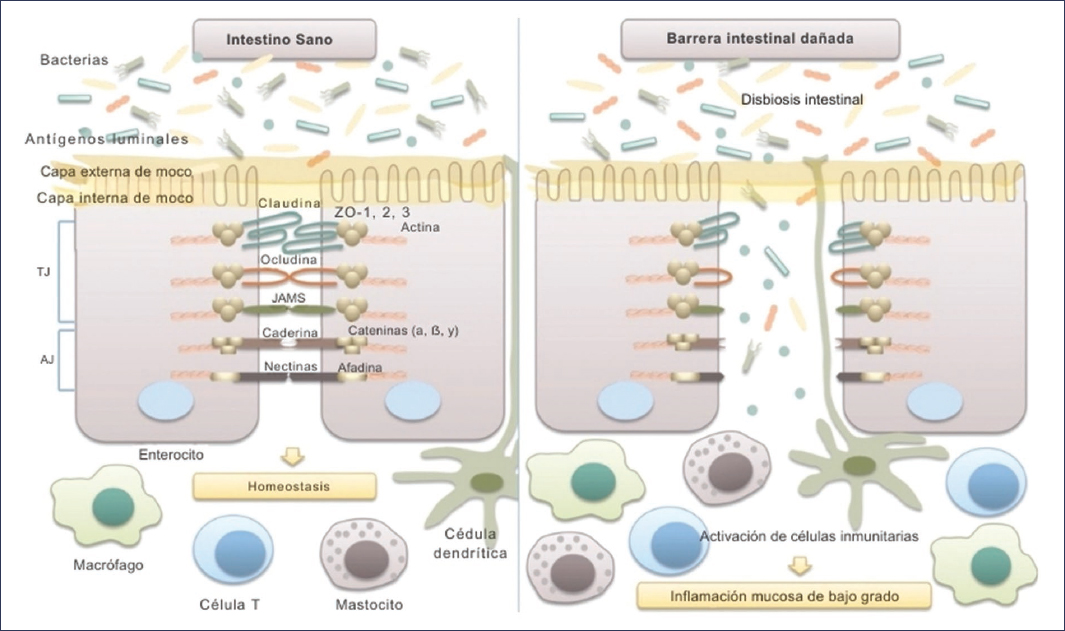
Figura 2. Microbiota e integridad de la barrera intestinal. La barrera intestinal cumple un papel esencial en el mantenimiento de la homeostasis del huésped. Está compuesta principalmente por la capa de moco, la capa epitelial y la lámina propia subyacente. Las células epiteliales intestinales están firmemente unidas entre sí mediante complejos de unión. Las uniones estrechas (TJ) están formadas por varias proteínas, entre ellas ocludina, claudinas, zónula occludens (ZO) y moléculas de adhesión de unión (JAMS), las cuales interactúan entre sí y con el citoesqueleto celular. La unión adherente (AJ) está conformada por el sistema nectina-afadina y el sistema E-cadherina-catenina. La integridad de la barrera epitelial intestinal impide la translocación de bacterias y antígenos luminales hacia la mucosa, evitando así su interacción con el sistema inmunitario del huésped y el desarrollo de una inflamación mucosa de bajo grado en la pared intestinal (traducida y adaptada de Mamieva et al.9).
Por otro lado, se ha descrito que la expresión de la ocludina y las claudinas 3 y 4 puede incrementarse en presencia de ácidos grasos de cadena corta (AGCC), los cuales son producidos predominantemente por microorganismos de los géneros Eubacterium, Clostridium, Ruminococcus y Faecalibacterium10.
Las poliaminas, en particular la putrescina, la espermidina y la espermina, son moléculas con carga positiva producidas por diversas bacterias. Se ha demostrado que estas poliaminas estimulan la síntesis de E-cadherina y la proteína de la zónula occludens 1, dos proteínas esenciales para preservar la integridad de la barrera intestinal. La E-cadherina facilita la adhesión entre las células epiteliales, mientras que la proteína de la zónula occludens 1 contribuye a la formación de uniones estrechas, evitando así el paso de sustancias intraluminales hacia el interior del organismo3,11. Ciertas bacterias intestinales pueden influir en el grosor y la composición de la capa de moco intestinal, entre las que destacan Bacteroides thetaiotaomicron, Faecalibacterium prausnitzii y especies del género Ruminococcus.
Las alteraciones relacionadas con la microbiota y la síntesis de las proteínas involucradas en la barrera intestinal contribuyen a un aumento de la permeabilidad intestinal, permitiendo el paso de antígenos luminales, componentes microbianos y sus metabolitos, los cuales estimulan de forma constante al sistema inmunitario. Como resultado, se produce la activación de linfocitos T y mastocitos en la mucosa intestinal, así como la proliferación de mediadores inflamatorios. Entre estos destacan niveles elevados de citocinas proinflamatorias, como las interleucinas (IL) 6 y 8, y una respuesta atenuada de citocinas antiinflamatorias, como la IL-10.
Los estudios clínicos comparativos con controles sanos han demostrado que los pacientes con SII presentan una mayor expresión de la proteína TGR5 (receptor Takeda acoplado a proteínas G), así como concentraciones significativamente elevadas de AGCC y ácidos biliares en muestras fecales, lo cual se ha relacionado con alteraciones en la absorción y la motilidad intestinales.
Además, se han identificado niveles elevados de triptófano, lo que sugiere una activación de la vía del receptor de hidrocarburos de arilo, potencialmente implicada en cambios en la señalización y en la sensibilidad visceral.
Disbiosis y síndrome de intestino irritable
La microbiota intestinal es indispensable para el mantenimiento de la homeostasis del huésped. Cerca del 90% de la población bacteriana en los adultos se compone predominantemente de Firmicutes, Bacteroides, actinobacterias y proteobacterias, microrganismos que participan en funciones metabólicas esenciales como el metabolismo de los hidratos de carbono, los aminoácidos y los lípidos, así como la síntesis de colesterol y de vitaminas (vitaminas K2, B1, B2, B6, B7, B9 y B12). Además, la microbiota mantiene la integridad de la barrera epitelial y tiene injerencia en la modulación de la respuesta inmunitaria y la protección frente a patógenos9,12.
Numerosos estudios han demostrado que los pacientes con SII tienen un incremento de géneros bacterianos como Bacteroides, mientras que poblaciones consideradas beneficiosas, como Bifidobacteria, Lactobacillus y Clostridium, están significativamente reducidas en comparación con los individuos sanos13, y aunque este patrón de disbiosis no es idéntico en todos los pacientes, la mayoría de los autores coinciden en que existe una disminución de la diversidad microbiana en los pacientes con SII. Específicamente, se describe que existe menor abundancia de bacterias productoras de butirato, como por ejemplo las del género Faecalibacterium, principalmente F. prausnitzii, así como un aumento en la abundancia de la familia Enterobacteriaceae, incluyendo patógenos como Eschericha coli y especies del género Enterobacter9. También se han reportado diferencias significativas en la cantidad de Lactobacillus, aunque para este los resultados no son concordantes, ya que en algunos estudios se reporta un incremento y en otros una disminución de este comensal11.
Se ha descrito que la disbiosis en los pacientes con SII afecta la producción de metabolitos como los ácidos biliares y los AGCC, y metabolitos de aminoácidos y derivados del triptófano14.
Los AGCC, como el acetato, el propionato y el butirato, son producidos a partir de la fermentación bacteriana de los hidratos de carbono. Estos metabolitos son esenciales para la nutrición de los enterocitos, además de desempeñar un papel clave en la modulación de la respuesta inflamatoria y en el mantenimiento de la integridad de la barrera intestinal14. Por otro lado, el catabolismo de proteínas y la posterior absorción de aminoácidos, en particular de triptófano, constituyen una vía relevante en la fisiopatología del SII. El triptófano, a través de su hidrólisis y transformación microbiana, actúa como precursor de la serotonina mediante la acción de enzimas como la triptófano hidroxilasa. Asimismo, los metabolitos indólicos derivados del triptófano pueden activar el receptor de hidrocarburos de arilo, modulando así la respuesta inflamatoria y regulando la integridad y la permeabilidad de la barrera intestinal. Las diferencias en la capacidad de la microbiota intestinal para metabolizar el triptófano pueden influir en la producción de serotonina, afectando de manera directa la sensibilidad visceral y la función motora intestinal, como se describió previamente14.
Los ácidos biliares son integradores de señales entre el metabolismo del colesterol, la función hepática y la acción microbiana. Se sintetizan en forma de ácidos biliares primarios (ácido cólico y ácido quenodesoxicólico) en el hígado a través de la acción enzimática de la colesterol 7α-hidroxilasa (CYP7A1) y se modifican en la luz intestinal a secundarios (como el ácido desoxicólico) mediante la acción de bacterias específicas, en particular del género Clostridium. Dichos metabolitos modulan la motilidad y la sensibilidad a través de receptores como el receptor X de tipo farnesoide y el receptor acoplado a proteína G, y sus alteraciones —por ejemplo, la malabsorción de ácidos grasos en el SII con predominio de diarrea (SII-D) — se han correlacionado con un aumento en la producción de serotonina y con disfunciones en la motilidad colónica14. Algunos estudios han demostrado que en sujetos con SII-D existe un aumento en los ácidos biliares primarios y una disminución en los secundarios, fenómeno que se ha correlacionado con la reducción de la familia Ruminococcaceae y con síntomas de diarrea y sensibilidad visceral15.
El papel de los agentes infecciosos
En la última década se ha hallado evidencia que sugiere que las infecciones pudieran tener un papel determinante en la fisiopatología del SII. A continuación, se resumen los aspectos más importantes de esta evidencia.
Uso de antibióticos y SII
La prescripción inadecuada de antibióticos, situación a la que se expone la población general, se ha asociado al desarrollo de síntomas gastrointestinales. Los antibióticos representan la causa más común y significativa de alteración en la microbiota intestinal16. El potencial de un agente antimicrobiano para afectar la microbiota intestinal radica en varios factores, como el espectro de su actividad, su dosis, su farmacocinética y el tiempo de su administración. Por ejemplo, es importante recalcar que la vía parenteral no está exenta de afectar la microbiota, ya que muchos de estos medicamentos (p. ej., ceftriaxona) pueden excretarse en la bilis y la saliva.
Respecto a la evidencia del abuso de antibióticos y el desarrollo de síntomas digestivos, existe un estudio que consistió en una encuesta a 421 sujetos en una práctica de atención primaria en el Reino Unido que recibieron antibióticos en un periodo de hasta 4 meses17. En este estudio se demostró que el uso de antibióticos se asoció fuertemente con un incremento del riesgo de padecer síntomas de SII de hasta tres veces más que los sujetos que no tomaron antibióticos (razón de momios [RM]: 3.7).
SII posinfeccioso
Aunque este concepto resulta ser novedoso desde el punto vista de solidez científica, hace más de 40 años McKendrick y Read18 reportaron por primera vez la aparición de síntomas gastrointestinales de forma tardía después de episodios de gastroenteritis agudas bacteriológicamente confirmadas. Desde entonces, muchos estudios han confirmado la existencia de esta relación19. Recientemente, la Fundación Roma conformó un grupo de trabajo que realizó una revisión sistemática de la literatura sobre las características clínicas, la fisiopatología (alteraciones sensoriomotoras intestinales, disbiosis, disfunción inmunitaria, alteraciones de la barrera epitelial, vías enteroendocrinas y genética) y los modelos animales de SII posinfeccioso (SII-Pi), y propuso unos criterios específicos para la definición de esta enfermedad20,21 (Tabla 1).
Tabla 1. Criterios diagnósticos para el síndrome de intestino irritable posinfeccioso
| Para el diagnóstico de síndrome de intestino irritable posinfeccioso se consideran los siguientes criterios basados en Roma IV |
|---|
| – Dolor abdominal recurrente al menos 1 día por semana en los últimos 3 meses, con inicio de los síntomas al menos 6 meses antes del diagnóstico, asociado a dos o más de los siguientes: |
| • Relación del dolor con la defecación |
| • Asociación con un cambio en la frecuencia de las evacuaciones |
| • Asociación con un cambio en la forma (apariencia) de las heces |
| – Desarrollo de los síntomas inmediatamente después de la resolución de una gastroenteritis infecciosa. |
| – Definición de gastroenteritis infecciosa: |
| • Confirmación mediante cultivo de heces positivo en un individuo sintomático, o |
| • Presencia de al menos dos de los siguientes síntomas en ausencia de cultivo disponible: |
| • Fiebre |
| • Vómito |
| • Diarrea |
| – Ausencia de diagnóstico previo de síndrome de intestino irritable antes del inicio de la enfermedad aguda. |
Una revisión sistemática y metaanálisis que incluyó 47 estudios con más de 28,000 individuos reportó una prevalencia global del 14.5% para SII-Pi y del 12.7% para dispepsia funcional posinfecciosa22. Además, se observó que el riesgo de desarrollar SII-Pi o dispepsia funcional posinfecciosa era significativamente mayor en quienes habían padecido gastroenteritis (RM: 4.3 y 3.0, respectivamente) en comparación con controles no expuestos. El SII-Pi persistió en cerca del 40% de los casos incluso después de 5 años. Las infecciones por parásitos mostraron la mayor prevalencia de SII-Pi (30.1%), seguidas de las bacterianas (18.3%) y virales (10.7%). En particular, Campylobacter fue el patógeno bacteriano con mayor asociación (20.7%), mientras que el SARS-CoV-2 y ciertas proteobacterias mostraron los mayores riesgos (RM: 5.4). Estos hallazgos refuerzan el papel de los agentes infecciosos proinflamatorios como desencadenantes clave de alteraciones funcionales persistentes del tracto gastrointestinal.
El mecanismo asociado al desarrollo de SII después de una infección, al parecer, es la perpetuación de una respuesta inflamatoria de bajo grado que persiste a lo largo del tiempo23. En esta respuesta, la liberación de citocinas, el incremento de linfocitos intraepiteliales y la infiltración por mastocitos y eosinófilos en la mucosa yeyunal y colónica (incluso en las capas más profunda, donde se localizan las terminaciones nerviosas) desempeñan un papel fundamental. Por ejemplo, Chadwick et al.24 evaluaron muestras de mucosa de colon de 77 pacientes con SII y encontraron que 31 tenían inflamación microscópica, y mediante inmunohistología observaron un incremento de linfocitos intraepiteliales, así como un incremento de células CD3+ y CD25+ en la lámina propia, todo esto como muestra de activación de mecanismos inmunitarios. Es atractivo pensar que estos cambios inflamatorios pueden resultar de la exposición a antígenos bacterianos o a componentes presentes en los alimentos25,26. Por otra parte, puede existir una predisposición a una respuesta inflamatoria intraluminal exagerada, basándose en los estudios que han demostrado la existencia de polimorfismos de genes que codifican para la producción de citocinas antinflamatorias.
Por otra parte, Pimentel et al.27 describieron que la toxina B de distensión citoletal (CdtB) producida por agentes infecciosos como Campylobacter, Shigella y Escherichia es capaz de desarrollar una reacción cruzada produciendo anticuerpos contra la vinculina, una proteína de enlace fundamental para la contractilidad del músculo liso. Así pues, en este modelo se plantea que las infecciones son la causa de la dismotilidad en algunos casos de SII. Incluso, en la actualidad se recomienda el uso de anticuerpos antivinculina y anti-CdtB en pacientes con SII-D o SII mixto, ya que en el estudio de validación se demostró que valores por arriba del punto de corte permiten diferenciar esta afección de otras, como por ejemplo la enfermedad inflamatoria intestinal.
Resulta particularmente interesante que, a raíz de la pandemia de COVID-19, se haya documentado que hasta el 7% de los infectados desarrollan SII (intervalo de confianza del 95% [IC 95%]: 5-8), con una mayor probabilidad de aparición dentro de los primeros 3 meses (6%; IC 95%: 2-10) y a los 6 meses (7%; IC 95%: 5-8), siendo el subtipo de SII-D el más prevalente (5%; IC 95%: 1-8)18.
La génesis del SII en pacientes pos-COVID-19 parece ser el resultado de una interacción compleja de múltiples mecanismos. Inicialmente, el SARS-CoV-2 ingresa a las células del tracto gastrointestinal a través de los receptores de la enzima convertidora de la angiotensina 2, altamente expresados en el intestino delgado, en particular en el íleon terminal y el duodeno. Esta invasión propicia la replicación viral local y el daño directo a las células epiteliales, comprometiendo la integridad de la barrera intestinal.
La alteración de la barrera intestinal favorece la disrupción del transporte iónico y de la absorción de nutrientes, además de inducir una respuesta inflamatoria caracterizada por el aumento de citocinas como la IL-8, lo que incrementa la permeabilidad intestinal y puede predisponer a una respuesta inmunitaria anómala. Estos cambios se asocian posteriormente a la hipersensibilidad visceral característica del SII. Además, la infección por SARS-CoV-2 se relaciona con disbiosis intestinal, evidenciada por una reducción en la diversidad y la riqueza microbiana, un incremento de patógenos oportunistas y una disminución de bacterias beneficiosas. Asimismo, la pérdida de la función reguladora de la enzima convertidora de la angiotensina 2 sobre la absorción de aminoácidos —por ejemplo, la disminución en la captación de triptófano— limita la síntesis de péptidos antimicrobianos, exacerbando el desequilibrio microbiano y la inflamación local19.
Por otra parte, el estrés agudo y crónico experimentado durante la infección y el confinamiento, así como la incertidumbre asociada a la enfermedad, activan el eje hipotálamo-hipófisis-adrenal, con la consecuente liberación de corticotropina y el aumento de catecolaminas. Este proceso altera la motilidad intestinal, modifica la secreción de neurotransmisores como la serotonina y deteriora la función de la barrera mucosa.
Finalmente, los tratamientos utilizados para la COVID-19, incluidos antibióticos de amplio espectro (azitromicina, vancomicina, ceftriaxona), antivirales (remdesivir, lopinavir/ritonavir), hidroxicloroquina, corticosteroides y, en muchos casos, el uso de polifarmacia, se han asociado a una disbiosis persistente y alteraciones en la función y la permeabilidad de la barrera intestinal, facilitando la translocación de antígenos luminales y la activación del sistema inmunitario local19.
SII y sobrepoblación bacteriana
Este tema será abordado en detalle en otro artículo de estas Clínicas; no obstante, es importante destacar que el papel de las bacterias como agentes implicados en el SII se ha sustentado en la hipótesis de que hasta el 80% de los pacientes con SII presentan sobrecrecimiento bacteriano28
–30. Este nuevo paradigma sugiere que el sobrecrecimiento bacteriano puede estar asociado con anormalidades en la función motora del intestino delgado y ser la causa de los síntomas (en especial de la distensión o inflamación abdominal), y más aún, que la erradicación de esta sobrepoblación bacteriana utilizando antibióticos no absorbibles (neomicina, rifaximina) se acompaña de una mejoría sintomática superior al 80%31.Inflamación de bajo grado y sistema inmunitario
Desde el punto de vista inmunológico, se ha demostrado que en el SII existe una activación sutil, pero significativa, de células efectoras, particularmente en proximidad a las fibras nerviosas, donde liberan mediadores como histamina, triptasa y proteasas. Estos mediadores no solo alteran la contractilidad intestinal, sino que también contribuyen a la sensibilización de las terminaciones nerviosas y a la manifestación de dolor abdominal2. Se ha identificado un aumento tanto en el número como en la activación de mastocitos, fenómeno que puede ocurrir por mecanismos dependientes o independientes de la inmunoglobulina E (IgE), subrayando la complejidad de la respuesta inflamatoria.
La interacción de los mastocitos y las terminales nerviosas da lugar a inflamación neurogénica, mediada por la liberación de neuropéptidos como la sustancia P y el péptido relacionado con el gen de la calcitonina, los cuales inducen la degranulación de mastocitos, amplifican la liberación de mediadores inflamatorios y sensibilizan aún más a las neuronas nociceptivas3.
En este proceso también participan diversas citocinas; entre ellas, citocinas proinflamatorias como la IL-1β y la IL-6, así como citocinas antiinflamatorias o tolerogénicas, como la IL-10 y el factor de crecimiento transformante beta, que son producidas por células epiteliales, estromales e inmunitarias bajo condiciones fisiológicas para mantener la homeostasis intestinal. Además, citocinas como la IL-4, la IL-5 y la IL-13 promueven respuestas alérgicas locales y la activación de mastocitos32.
Un mecanismo clave en la respuesta inmunitaria intestinal es la activación de los receptores Toll-like (TLR), encargados de reconocer componentes microbianos denominados patrones moleculares asociados a patógenos. Estos receptores, expresados tanto en células epiteliales como en células inmunitarias residentes en la mucosa, activan tras su estimulación una cascada intracelular que culmina en la activación del factor nuclear kappa B y la liberación de citocinas y mediadores inflamatorios. En condiciones normales, este proceso contribuye al establecimiento de la tolerancia inmunitaria hacia la microbiota comensal, manteniendo a la vez la capacidad de respuesta frente a patógenos. Sin embargo, en el contexto del SII se ha observado una sobreexpresión de TLR-4 y TLR-5, receptores que detectan lipopolisacáridos y flagelinas bacterianas, respectivamente. Esta sobreexpresión facilita la activación de respuestas inmunitarias exageradas incluso ante alteraciones sutiles de la microbiota, favoreciendo la producción de citocinas como la IL-6 y el factor de necrosis tumoral alfa33.
La histamina, sintetizada a partir de la histidina mediante la acción de la histidina descarboxilasa, desempeña un papel central en las respuestas inmunitarias e inflamatorias. En el intestino, la histamina es liberada principalmente por los mastocitos y los basófilos, aunque también puede ser producida por microorganismos que expresan esta enzima. De particular interés en el SII son los receptores H1 y H4 de la histamina, implicados en la sensibilización de las terminaciones nerviosas, facilitando, entre otros mecanismos, la activación de canales como TRPV1, y contribuyendo así a la transmisión del dolor34.
Alteraciones en la motilidad intestinal
Las alteraciones motoras del tracto gastrointestinal representan un componente fundamental en la fisiopatología del SII. Diversos estudios han documentado anomalías en la motilidad tanto del intestino delgado como del colon. En el intestino delgado se han observado patrones de tránsito acelerado o enlentecido, lo que puede contribuir a manifestaciones como la diarrea o la distensión abdominal35. En el colon, los pacientes con SII muestran alteraciones en la frecuencia, la amplitud y la propagación de las contracciones motoras, especialmente de las contracciones propulsivas, lo que condiciona cambios en el tránsito y en la evacuación intestinal. Estas disfunciones motoras parecen ser moduladas, en parte, por una regulación anómala del sistema nervioso entérico y del eje intestino-cerebro, además de tener influencias de factores luminales (microbiota) y hormonales (péptidos intestinales)36. En el SII-D predominan una hipermotilidad colónica y un tránsito acelerado, mientras que en el SII con constipación (SII-C) se han descrito una motilidad disminuida y un tránsito lento1. En concreto, existe evidencia de una respuesta motora colónica exagerada a estímulos como la ingesta de alimentos o la distensión rectal, fenómeno conocido como hipersensibilidad motora posprandial37. Asimismo, se ha identificado que la disfunción de la coordinación anorrectal puede contribuir a la sensación de evacuación incompleta o dificultad defecatoria, particularmente en pacientes con SII-C38. En conjunto, estas alteraciones motoras reflejan la interacción de procesos de disfunción neuromuscular, hipersensibilidad visceral e influencias inflamatorias e inmunitarias de bajo grado, característicos del SII.
Eje intestino-cerebro: neurotransmisores y estrés
Uno de los pilares fundamentales en la fisiopatología del SII es la alteración en la comunicación bidireccional entre el SNC y el tracto gastrointestinal (Fig. 3). En condiciones normales, este eje permite la regulación coordinada de las funciones motoras, sensoriales y secretoras del sistema digestivo. En los pacientes con SII, diversas técnicas de neuroimagen han revelado alteraciones en la arquitectura y la conectividad de varias redes cerebrales, entre las que destacan:
- – Red por defecto: comprende áreas como la corteza prefrontal medial, la corteza cingulada posterior, la precuña, la corteza parietal inferior, la corteza temporal lateral y la formación hipocampal. Esta red se encarga de la autorreflexión, el procesamiento de la memoria episódica y la gestión de pensamientos internos. En el SII, la disfunción de esta red, evidenciada por alteraciones en su conectividad funcional y estructural, puede contribuir a una menor modulación del dolor visceral y a una atribución anómala de la atención a estímulos internos, lo cual se asocia con la intensidad y la cronicidad de los síntomas24.
- – Red de saliencia: encargada de detectar, filtrar y priorizar estímulos relevantes del entorno tanto interno (sensaciones viscerales) como externo. Involucra principalmente la corteza prefrontal medial y orbitofrontal, la corteza cingulada anterior media, la ínsula anterior y la amígdala. En el SII se ha observado una hiperactivación de esta red, por ejemplo, ante la distensión rectal, fenómeno que se ha relacionado con una mayor percepción del dolor y un procesamiento emocional intensificado de las señales viscerales24,25.
- – Red ejecutiva central: participa en funciones cognitivas de alto nivel, como la atención, la memoria de trabajo y el control inhibitorio. Está asociada a la corteza prefrontal lateral y a las áreas parietales posteriores. En el SII se han reportado déficits en la conectividad y en la activación de esta red durante tareas cognitivas o ante estímulos dolorosos, lo que podría favorecer una atención desproporcionada a los síntomas y dificultades en la modulación de la respuesta al dolor24,26.
- – Red autonómica central: regula la homeostasis corporal a través del control de las respuestas visceromotoras, neuroendocrinas y del procesamiento del dolor. Está conformada por estructuras como la corteza insular, la amígdala, el hipotálamo, la sustancia gris periacueductal y el locus coeruleus, entre otras. En el SII, su disfunción se traduce en una alteración de la modulación autonómica.
- – Redes de procesamiento emocional: encargadas de la evaluación y la respuesta emocional, incluyen la amígdala, el hipocampo, el hipotálamo y áreas de la corteza prefrontal. Su disfunción en el SII se asocia a una mayor ansiedad, una percepción exagerada del dolor y una reactividad incrementada a estímulos interoceptivos24.
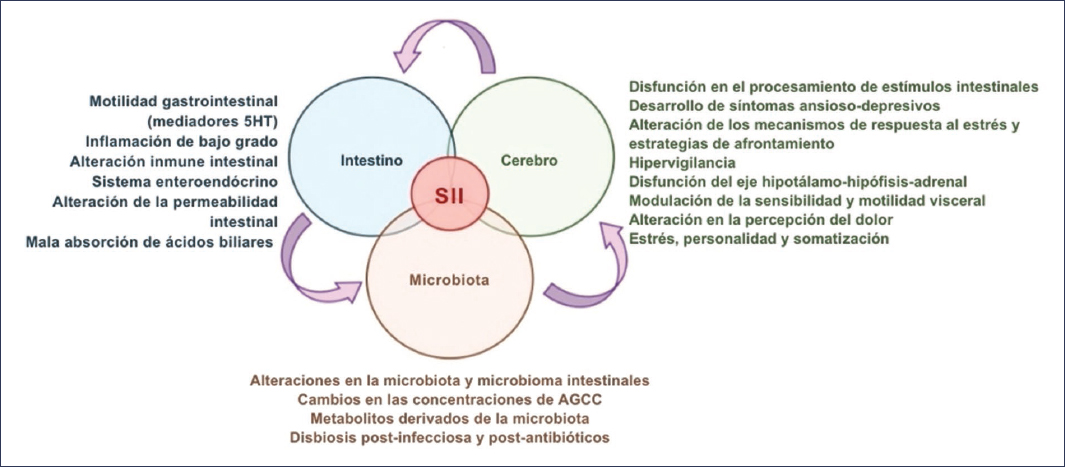
Figura 3. El eje microbiota-intestino-cerebro hace referencia a las vías de comunicación bidireccionales entre el sistema nervioso central, el sistema nervioso entérico, el tracto gastrointestinal y la microbiota intestinal. Esta red compleja de interacciones, cuando se encuentra alterada, contribuye a diversos mecanismos fisiopatológicos subyacentes al síndrome de intestino irritable. AGCC: ácidos grasos de cadena corta; 5-HT: serotonina (5-hidroxitriptamina) (traducida y adaptada de Pellegrino et al.12).
Finalmente, mediando la señalización a lo largo del eje cerebro-intestino se encuentran neurotransmisores, como la serotonina, la noradrenalina y la dopamina, cuya participación es crucial no solo en la fisiopatología, sino también como diana de las estrategias terapéuticas actuales.
Diversos estudios han demostrado que el estrés crónico y los trastornos emocionales, como la ansiedad y la depresión, se asocian con alteraciones del microbioma intestinal, lo que a su vez puede exacerbar los síntomas gastrointestinales, y viceversa39.
En este rubro, las experiencias adversas en la infancia, como el abuso emocional (especialmente en las mujeres), el abuso sexual (especialmente en los hombres) y el abuso de sustancias en el entorno familiar, predisponen a un mayor riesgo de desarrollar SII. Esto se sustenta en una hiperactividad del eje hipotálamo-hipófisis-adrenal que lleva a una disfunción del eje cerebro-intestino. En un estudio realizado por Lee et al.40 se observó que, tanto en mujeres como en hombres, la presencia de al menos una experiencia adversa en la infancia duplicaba la probabilidad de tener SII (RM global: 2.11; IC 95%: 1.58-2.82; p = 5.09 E–7), y cada incremento unitario en la puntuación de experiencias adversas en la infancia aumentaba el riesgo un 18%. Entre las categorías específicas, el antecedente de enfermedad mental en el hogar mostró la evidencia estadística más robusta, incrementando significativamente el riesgo tanto en mujeres (RM: 1.95; IC 95%: 1.35-2.85; tasa de falsos descubrimientos [FDR]: 0.002) como en hombres (RM: 2.32; IC 95%: 1.26-4.33; FDR: 0.014). Además, se identificó que el abuso emocional fue un predictor destacado en las mujeres (RM: 1.94; IC 95%: 1.23-3.09; FDR: 0.019), mientras que en los hombres fue determinante el abuso sexual (RM: 3.54; IC 95%: 1.35-10.38; FDR: 0.027)40.
En un estudio transversal realizado en México, que incluyó 290 adultos (90 con SII y 200 controles sanos), se evaluó la prevalencia de experiencias adversas en la infancia y su asociación con el SII41. Los participantes completaron cuestionarios validados para experiencias adversas, sensibilidad visceral, gravedad de los síntomas de SII y síntomas de ansiedad y depresión. Los resultados mostraron que el 80% de los sujetos con SII reportaron al menos una experiencia adversa, significativamente más que el 59% en el grupo control (p < 0.0001). Además, el 75% de los pacientes con SII y síntomas graves refirieron haber vivido cuatro o más experiencias adversas, lo cual se asoció a un mayor riesgo de padecer SII. Asimismo, los individuos con experiencias adversas presentaron niveles elevados de ansiedad y depresión. Estos hallazgos destacan la alta prevalencia de experiencias adversas en la infancia entre los mexicanos con SII, así como la importancia de incorporar su evaluación en el abordaje integral de esta enfermedad en poblaciones latinoamericanas.
Genética y epigénetica en el síndrome de intestino irritable
En lo que respecta a los factores genéticos, se han identificados variantes génicas que están relacionadas con la susceptibilidad a padecer SII, así como con neurotransmisores, procesos inflamatorios y motilidad intestinal. Contar con un familiar que padezca de SII se ha asociado fuertemente con el desarrollo de SII en adultos (RM: 2.17; IC 95%: 1.89-2.49; p < 0.0001)42. En estudios realizado en gemelos se ha reconocido la heredabilidad del SII, teniendo una mayor concordancia en gemelos monocigóticos (33%) que en gemelos dicigóticos (13%)43.
En el estudio de Bonfiglio et al.44 se documenta la relación del locus 9q31.2 (polimorfismo de nucleótido único rs10512344) con el riesgo de padecer SII, y se realiza la asociación con predominancia a la variante SII-C en las mujeres. Dicho locus se ha relacionado principalmente con la regulación de la membrana de transporte iónico celular y las mutaciones en el gen de la sucrasa-isomaltasa, así como la disfunción autonómica12.
En otro estudio, Huang et al.45 identificaron 10 locus de riesgo para el SII, de los cuales siete fueron novedosos y algunos de ellos codifican los siguientes genes (COP1, LRP1B, SUGT1, MED12L, P2RY14 y SHISA6), y confirmaron genes ya conocidos en el SII, entre ellos PRRC2A, CADM2 y PHF2. En particular, PRRC2A se mapea a la variante rs2736155 y ha sido relacionado con la respuesta inmunitaria del intestino, lo que podría influir en la susceptibilidad y en la respuesta patológica del SII45.
Por otra parte, se han identificado mecanismos epigenéticos que desempeñan un papel fundamental en la plasticidad sináptica, mecanismos de dolor y depresión. Los cambios epigenéticos involucrados en esta patología son la metilación del ADN, la modificación de histonas y la regulación de genes mediada por ARN no codificantes46.
La metilación implica la adición de un grupo metilo (–CH3) a la posición C5 de la citosina, especialmente en dímeros citosina-fosfato-guanina (CpG). Las regiones con alta concentración de CpG, que con frecuencia se ubican en los promotores de los genes, normalmente se encuentran sin metilar. La metilación, en consecuencia, tendrá participación en el cierre de la cromatina y la represión de la transcripción génica. En pacientes con SII se han detectado patrones alterados de metilación en genes relacionados con la respuesta al estrés (como el receptor de glucocorticoides) y otros genes implicados en la función neuronal46.
Las histonas, proteínas fundamentales en la organización de la cromatina al facilitar el enrollamiento del ADN, pueden experimentar diversas modificaciones covalentes, como la acetilación y la metilación. Estas modificaciones epigenéticas son sensibles a factores ambientales, como el estrés, el cual puede alterar dichos procesos y, dependiendo de las regiones génicas afectadas, influir en la modulación del dolor visceral46.
En lo que respecta al ARN no codificante, están los micro-ARN (miARN) y los ARN largos no codificantes (lncARN). Los miARN son pequeñas moléculas de ARN no codificante, de aproximadamente 18 a 25 nucleótidos de longitud, que regulan la expresión génica postranscripcional. Su mecanismo principal consiste en unirse a la región no traducida 3’ (3’-UTR) de los ARNm diana, lo que conlleva su degradación o la inhibición de su traducción. Diversos miARN, como miR-510, miR-29a y miR-144, entre otros, han mostrado niveles alterados tanto en pacientes con SII como en modelos experimentales47. Estos miARN modulan genes clave implicados en la regulación de la permeabilidad intestinal, la sensibilidad visceral al dolor y la función del neurotransmisor serotonina.
Los lncRNA son transcritos de más de 200 nucleótidos que, a pesar de no codificar proteínas, cumplen funciones clave en la regulación de procesos transcripcionales y traduccionales. Estos ARN pueden interactuar con proteínas reguladoras y participar en la remodelación de la cromatina, modulando así la expresión génica. Se han identificado lncRNA relevantes, como XIST y GHRLOS, implicados en la regulación de la expresión del transportador de serotonina y de la motilina, lo cual contribuye a la comprensión de los mecanismos de hipersensibilidad visceral y de las alteraciones en la motilidad gastrointestinal asociadas al SII46.
Nuevos mecanismos fisiopatológicos
Más allá de los mecanismos clásicos —como la alteración del eje intestino-cerebro, la disbiosis y la hipersensibilidad visceral— se han identificado elementos emergentes que podrían desempeñar un papel relevante en el desarrollo y la perpetuación de la enfermedad.
Entre ellos, destaca el impacto del consumo de alimentos ultraprocesados, cuya creciente incorporación en la dieta occidental se ha correlacionado con un aumento en la incidencia del SII. A su vez, la exposición ambiental a contaminantes atmosféricos y las condiciones de higiene durante la infancia se han vinculado con alteraciones inmunitarias e inflamatorias que favorecen la disfunción intestinal.
De manera particularmente novedosa, se ha propuesto que la gravedad —como fuerza física constante que afecta la distribución de los órganos, la circulación sanguínea y los gradientes de presión en el tracto gastrointestinal— podría también contribuir al desarrollo de síntomas funcionales, al alterar tanto la motilidad intestinal como la sensibilidad visceral en ciertos individuos susceptibles.
La integración de estos nuevos conceptos permite una visión más amplia y compleja del SII, subrayando la interacción de factores dietéticos, ambientales, inmunitarios, microbiológicos y físicos en su fisiopatología, y abriendo la puerta a nuevas estrategias de prevención y tratamiento.
Consumo de alimentos ultraprocesados
El incremento en la prevalencia del SII ha coincidido con el aumento en el consumo de alimentos ultraprocesados. En un estudio realizado por Wu et al.48 se documentó que, a mayor consumo de alimentos ultraprocesados, mayor riesgo de desarrollar SII. Específicamente, cada incremento del 10% en la proporción de alimentos ultraprocesados en la dieta se relacionó con un aumento del 8% en el riesgo de SII (HR (Hazard ratio): 1.08; IC 95%: 1.04-1.12).
Existen varios mecanismos que pueden explicar la asociación entre el consumo de alimentos ultraprocesados y el desarrollo de SII. Este grupo de alimentos suelen presentar altos contenidos de azúcares, grasas saturadas y calorías, junto a bajos niveles de fibra, vitaminas y micronutrientes. Esta composición puede favorecer un desequilibrio en la regulación energética y promover un estado proinflamatorio en la mucosa intestinal. Los alimentos ultraprocesados pueden contener altas concentraciones de oligosacáridos, disacáridos, monosacáridos y polioles (FODMAP). Un consumo elevado de FODMAP puede aumentar el volumen de agua en el intestino delgado y la producción de gases en el colon, y estos cambios fisiológicos pueden generar síntomas característicos del SII; este tema en particular se trata en otro artículo de esta Clínica. Uno de los mecanismos más destacados se relaciona con los aditivos presentes en estos alimentos (emulsionantes, espesantes y otros agentes conservadores), que pueden alterar la composición y la función de la microbiota intestinal, reduciendo la producción de AGCC que son importantes para mantener la integridad de la mucosa48.
Exposición medioambiental
En estudios recientes se ha observado una asociación entre la contaminación del aire (especialmente por partículas PM 2.5 y liberaciones tóxicas) y el incremento en la incidencia del SII, asociado a que las micropartículas inhaladas pueden atravesar la barrera alveolar, ingresar al torrente sanguíneo y llegar al sistema digestivo. La exposición a estas partículas puede desencadenar una respuesta inflamatoria sistémica y aumentar el estrés oxidativo, lo que puede dañar la mucosa intestinal y alterar la función inmunitaria local. Así mismo, en modelos animales se ha evidenciado que al estar expuesto a concentraciones elevadas de micropartículas se presenta disbiosis intestinal y, por consiguiente, alteración en el eje intestino-cerebro49.
Otros factores ambientales son la exposición a mascotas y los aspectos de higiene durante la infancia. Los estudios observacionales han mostrado que la tenencia de mascotas (en especial herbívoros, como caballos o aves) y la falta de medidas higiénicas adecuadas en la infancia pueden predisponer al individuo a un perfil inmunitario desviado hacia una respuesta Th2. Esta polarización puede estar relacionada con la mayor densidad de mastocitos IgE+ y el aumento de la permeabilidad intestinal, que se han vinculado a la aparición de un fenotipo «atópico» del SII en el que coexisten síntomas gastrointestinales con manifestaciones alérgicas49.
Hipótesis gravitacional
Un enfoque innovador que ha emergido recientemente en la fisiopatología del SII es la denominada «hipótesis de la gravedad»50. Esta propuesta busca integrar las múltiples teorías previamente desarrolladas (alteraciones en la motilidad, disfunción del eje intestino-cerebro, disbiosis y trastornos del sistema nervioso autónomo) bajo un modelo unificador basado en la interacción del cuerpo humano y la fuerza gravitacional. Según esta hipótesis, el SII podría resultar de una falla en los sistemas anatómicos, fisiológicos y neuropsicológicos encargados de gestionar adecuadamente los efectos de la gravedad. Desde el punto de vista anatómico, estructuras como el mesenterio, las taeniae coli, la columna vertebral, la caja torácica, el diafragma y la pared abdominal anterior funcionan de manera integrada para suspender y estabilizar los órganos dentro de la cavidad peritoneal, resistiendo el arrastre gravitacional. Cuando estos sistemas de resistencia mecánica son defectuosos —como ocurre en los trastornos de hipermovilidad, el envejecimiento o las alteraciones musculoesqueléticas— se favorecen fenómenos como la dismotilidad, la estasis luminal y la sobrecarga microbiana, todos ellos relevantes en el desarrollo del SII.
En paralelo, la hipótesis de la gravedad plantea que la percepción del «estrés gravitacional» por el sistema nervioso periférico y central, a través de mecanismos de detección (sensibilidad visceral) y vigilancia (hipervigilancia a estímulos internos), puede amplificar la respuesta sintomática mediante procesos de sensibilización periférica y central. Así, la hiperactividad de sistemas como el barorreflejo cardiovascular, el aparato vestibular o las redes de procesamiento emocional contribuiría a la hipersensibilidad visceral, el dolor abdominal y la respuesta emocional exacerbada típicos del SII. La serotonina, un neurotransmisor clave en la motilidad gastrointestinal y la modulación del dolor, también desempeña un papel central en esta propuesta, actuando como un mediador evolutivo en la adaptación a la gravedad.
En conjunto, la hipótesis de la gravedad ofrece una visión integradora que conecta factores mecánicos, microbianos, inmunitarios y neuropsicológicos, proponiendo que la incapacidad para manejar adecuadamente la constante fuerza gravitacional podría ser un factor primario en la patogénesis del SII. Esta perspectiva no solo amplía la comprensión de la enfermedad, sino que también abre nuevas vías para la investigación diagnóstica y terapéutica, centradas en mejorar la biomecánica corporal, modular la sensibilidad al estrés gravitacional y restaurar la homeostasis intestinal.
Conclusiones
Considerando que ya en su descripción original el SII se enfocó en un diagnóstico basado en síntomas, resulta obvio que el tratamiento ha ido dirigido a la mejoría de estos. Si se considera que desde la descripción de los criterios de Manning hasta los criterios de Roma IV el dolor abdominal ha sido el síntoma principal de esta enfermedad, es lógico pensar que la terapia se haya enfocado a la mejoría del dolor abdominal. Sin embargo, con la evolución en la definición se sabe que la mejoría del dolor no puede considerarse como el único objetivo en el tratamiento, y se ha reconsiderado que también el alivio de la distensión abdominal y la mejoría en la frecuencia y la consistencia de las evacuaciones deben incluirse como objetivos terapéuticos en el SII. Aún más, se sabe que la afectación de la calidad de vida e incluso las implicaciones económicas son factores determinantes en el SII, y por tanto es lógico pensar que estos dos parámetros deberían evaluarse cuando se quiera medir la eficacia terapéutica de cualquier intervención (farmacológica o no) en el SII.
Así pues, el manejo actual de un paciente que sufre síntomas de SII se considera que debe ser un tratamiento «integral», dirigido a la mejoría global de los síntomas y de la calidad de vida del paciente, y con un adecuado perfil de seguridad. El tratamiento puede basarse en el síntoma más molesto para el paciente (dolor abdominal o distensión), en el hábito intestinal predominante (diarrea o estreñimiento) o en la fisiopatología de la enfermedad (p. ej., comorbilidad psiquiátrica, hipersensibilidad visceral, etc.).
El SII debe ser entendido como una enfermedad compleja y dinámica, en la que mecanismos clásicos como la hipersensibilidad visceral y la disbiosis conviven con hallazgos emergentes que incluyen alteraciones epigenéticas, infecciones previas, cambios ambientales y desregulación del eje cerebro-intestino. La integración de estos mecanismos lleva a la necesidad de una visión diagnóstica y terapéutica integral, personalizada y basada en el perfil clínico y fisiopatológico de cada paciente.
Financiamiento
Los autores declaran no haber recibido financiamiento para este estudio.
Conflicto de intereses
S.P. Mendivil-Saenz no tiene conflicto de intereses. J.M. Remes-Troche es asesor y miembro de consejos consultivos para Asofarma, Carnot, Pro.Med.CS. Praha a.s. y Pisa, y conferencista para Asofarma, Abbot, Carnot, Chinoin, Ferrer, Johnson y Johnson, Medix y Medtronic.
Consideraciones éticas
Protección de personas y animales. Los autores declaran que para esta investigación no se han realizado experimentos en seres humanos ni en animales.
Confidencialidad, consentimiento informado y aprobación ética. El estudio no involucra datos personales de pacientes ni requiere aprobación ética. No se aplican las guías SAGER.
Declaración sobre el uso de inteligencia artificial. Los autores declaran que no utilizaron ningún tipo de inteligencia artificial generativa para la redacción de este manuscrito.
