Introducción
El diagnóstico de síndrome de intestino irritable (SII) se realiza basándose en los síntomas, los cuales incluyen dolor abdominal asociado a cambio en la forma o la frecuencia de las evacuaciones, siendo la escala de Bristol de gran utilidad para caracterizar los tipos de evacuaciones1 (Tabla 1). Los síntomas suelen variar en intensidad y frecuencia, y pueden agravarse en situaciones de estrés. Los cambios en el hábito defecatorio permiten subclasificar al SII en cuatro subtipos: con predominio de diarrea (SII-D), con predominio de estreñimiento (SII-E), con patrón mixto (SII-M) alternando entre diarrea y estreñimiento, y no clasificable (SII-NC) cuando no cumple con los criterios de los tres anteriores. La información publicada recientemente indica que la prevalencia de SII-E, SII-D y SII-M es similar, siendo el menos frecuente el SII-M2.
Tabla 1. Criterios diagnósticos Roma IV para síndrome de intestino irritable
| SII-E | SII-D | SII-M | SII-NC |
|---|---|---|---|
| > 25% de evacuaciones duras (Bristol 1-2) y < 25% líquidas (Bristol 6-7) Al menos una evacuación diaria alterada en cuanto a forma El predominio de estreñimiento se establece cuando la evacuación se realiza sin la ingesta de medicamentos |
> 25% de evacuaciones líquidas (Bristol 6-7) y < 25% de evacuaciones duras (Bristol 1-2) Al menos una evacuación diaria alterada en cuanto a forma El predominio de diarrea se establece cuando la evacuación se realiza sin la ingesta de medicamentos |
> 25% de evacuaciones líquidas (Bristol 6-7) y > 25% de evacuaciones duras (Bristol 1-2) | Los pacientes cumplen los patrones diagnósticos para SII, pero su patrón evacuatorio no puede clasificarse en ninguno de los otros tres tipos |
|
SII-D: síndrome de intestino irritable con predominio de diarrea; SII-E: síndrome de intestino irritable con predominio de estreñimiento; SII-M: síndrome de intestino irritable con patrón mixto; SII-NC: síndrome de intestino irritable no clasificado. |
|||
Fenotipos y endofenotipos emergentes
Los endofenotipos en el SII son subgrupos específicos de síntomas o características presentes en el paciente, que pueden ayudar a identificar diversas formas de la enfermedad y mejorar el tratamiento individualizado. Estos endofenotipos contribuyen a comprender de mejor forma cómo se manifiesta el SII en diferentes personas y cómo poder ofrecer el mejor tratamiento para cada caso. Dentro de los endofenotipos o mecanismos fisiopatológicos se incluyen la hipervigilancia del sistema nervioso central, los factores psicosociales, la predisposición genética y algunos mecanismos involucrados directamente en el tracto gastrointestinal. Sin embargo, con frecuencia se cree que el SII es un trastorno de la interacción del eje intestino-cerebro, pero es importante mencionar que existen mecanismos intestinales que pueden corregirse sin utilizar neuromoduladores de acción central. La hipnoterapia, la psicoterapia y la neuromodulación central pueden ser útiles en pacientes seleccionados. No obstante, es importante identificar los mecanismos fisiopatológicos en el intestino para individualizar el tratamiento. De este modo, además de los mecanismos fisiopatológicos ya descritos presentes en el SII, existe evidencia de que el intestino puede presentar daño directo por productos de la digestión de los alimentos, neurotransmisores, antecedentes de enteritis, microbioma, activación inmunitaria en la mucosa y aumento de la permeabilidad intestinal3. Estos factores desencadenan trastornos en la motilidad intestinal, alteración en la sensibilidad y trastornos de la defecación.
Por tanto, los subgrupos fisiopatológicos de importancia en el SII son los trastornos de la defecación, el tránsito colónico anormal, la diarrea por ácidos biliares, la hipersensibilidad colónica y rectal, la deficiencia de disacaridasa, las reacciones locales inmunomediadas por alimentos y la alteración en la microbiota. Por ello, se han realizado diversos estudios para conocer la fisiopatología y además se han desarrollado pruebas para facilitar la identificación de los mecanismos que producen los síntomas en los pacientes.
Trastornos de la defecación
Los trastornos de la defecación simulan los síntomas del SII-E, los cuales incluyen vaciamiento incompleto del colon izquierdo que produce distensión abdominal, dolor abdominal y estreñimiento. Los trastornos de la defecación pueden ser el resultado de un tránsito colónico retardado, en particular en el colon izquierdo4. También, en la práctica clínica, se identifican dos subtipos de disfunción del piso pélvico: trastornos de la evacuación espástica, en la cual el músculo puborrectal es espástico (disinergia)5, o relajación ineficiente del esfínter anal (anismo). Una segunda categoría representa un trastorno de flacidez, especialmente en el síndrome de descenso del perineo6, o síndrome de Ehlers-Danlos, de tipo vascular o hipermovilidad, con pérdida de soporte del tejido conectivo del perineo7,8. El diagnóstico de estos trastornos defecatorios se realiza mediante manometría anorrectal con prueba de expulsión de balón, y el parámetro más útil es el aumento de la presión del esfínter anal en reposo, así como también un índice de presión rectoanal negativo y un tiempo prolongado de expulsión del balón según el sexo y la edad.
Alteración motora
La alteración motora se puede evidenciar por medio de estudios no invasivos, como el uso de marcadores radioopacos o gammagrafía. El estudio del tránsito colónico no está indicado como abordaje inicial, pero puede realizarse en caso de pobre respuesta a los tratamientos de primera línea, como loperamida en el SII-D o fibra y laxante osmótico en el SII-E. La medición del tránsito colónico es un biomarcador diagnóstico que excluye trastornos rectales defecatorios en pacientes con evidencia de tránsito colónico lento4. Sin embargo, el tránsito colónico no es útil para diferenciar el SII-D de la diarrea funcional ni el SII-E del estreñimiento funcional9. En pacientes con tránsito colónico acelerado con SII-D, el propósito de realizar este estudio es para corroborar la gravedad de la diarrea o el impacto de la elección del tratamiento farmacológico en el tratamiento, o agregar un medicamento de segunda línea, como un antagonista de la 5-hidroxitriptamina (5-HT3), a un tratamiento de primera línea, como la loperamida. En caso de un tránsito colónico retardado, la determinación del tránsito colónico puede indicar la necesidad de agregar un secretagogo a un laxante osmótico de primera línea para el estreñimiento del SII-E.
Hipersensibilidad visceral
Adicionalmente, en el SII puede estar presente una hipersensibilidad o hipervigilancia por señalización visceral. En un estudio clásico realizado por Ritchie10, los pacientes con SII tenían sensibilidad rectal a la distensión con balón y presentaban sensación de dolor con menor volumen de distensión que los controles sanos. Por otro lado, en estudios posteriores se demostraron dos tipos distintos de sensibilidad rectal: hipersensibilidad o hiperalgesia11. Así, hay pacientes en los que la distensión del balón en el recto produce dolor u otras sensaciones con menos volumen de distensión, mientras que aquellos con un umbral menor de sensibilidad presentan malestar o hiperalgesia en relación con hipervigilancia o con una alteración en la regulación de la señalización visceral aferente. De manera importante, los puntajes de dolor reportados por los pacientes son subjetivos y están influenciados por sus padecimientos psicosociales12. En estudios moleculares se han hecho registros de la actividad del calcio en biopsias de recto y se ha observado un aumento en la excitabilidad de las neuronas submucosas en respuesta a agonistas de los canales pronociceptivos de los potenciales receptores transitorios (TRP vaniloides [TRPV1, TRPV4 y TRP anquirina 1 [TRPA1)13. Esta información demuestra que la intervención directa en los mecanismos periféricos involucrados en la señalización del dolor pueden ser un blanco terapéutico cuando están asociados a hipervigilancia visceral.
Malabsorción de sales biliares
En un estudio, uno de cada cuatro pacientes con SII-D presentaron diarrea por malabsorción de ácidos biliares14. Cerca del 90-95% de los ácidos biliares se reabsorben en el íleon terminal por el transportador activo apical de ácidos biliares acoplado a sodio. Estos ácidos biliares entran al ciclo enterohepático y el restante 5-10% pasan a través del colon, en donde producen un aumento de la permeabilidad por su efecto detergente. Una vez en el colon, los ácidos biliares primarios se desconjugan con la remoción de glicina y taurina, y se convierten en ácidos biliares secundarios a través de la epimerización de la microbiota colónica. Los principales ácidos biliares secundarios son el ácido litocólico, el ácido desoxicólico y el ácido ursodesoxicólico. En el colon, los ácidos biliares provocan un aumento en la secreción y un aumento de la permeabilidad mucosa, y estimulan la motilidad (contracciones colónicas de gran amplitud)15. En la actualidad contamos con tres parámetros bioquímicos válidos para el diagnóstico de diarrea por ácidos biliares16: cuantificación de los ácidos biliares fecales de 48 horas, determinación de los ácidos biliares primarios en heces y C4 sérico en ayuno (recolectado antes de las 9:00 a.m.). Un método adicional disponible en algunos países es la gammagrafía con ácido homocólico de taurina marcado con selenio-75 (75SeHCAT) de retención después de 7 días.
El abordaje actual del SII se basa en realizar el diagnóstico a partir de los síntomas, y por lo tanto, en ausencia de pruebas de escrutinio que se encuentren ampliamente disponibles y no sean costosas, los pacientes con diarrea por ácidos biliares se incluyen en el SII-D o en la diarrea funcional. Con la introducción y la disponibilidad de pruebas serológicas y en heces sencillas de realizar, los pacientes con diarrea por ácidos biliares deberán ser excluidos del diagnóstico de SII-D.
Mala digestión o malabsorción de hidratos de carbono
El intestino delgado normal absorbe monosacáridos y disacáridos en presencia de disacaridasa en cantidad normal: por lo general, estos son absorbidos en los primeros 2 metros de intestino delgado17 y la absorción de monosacáridos de la luz intestinal en igual cantidad. Los monosacáridos son transportados por mecanismos mediadores a través de los bordes en cepillo de los enterocitos, y poco más del 50% de estos transportadores son dependientes del gradiente de ion sodio. Cualquier hidrato de carbono mal digerido o malabsorbido que llega al colon es metabolizado por las bacterias colónicas, por lo que se producen gas, dióxido de carbono y agua, y en consecuencia un aumento de la carga osmótica que produce diarrea. De hecho, del 25% al 75% de los pacientes con deficiencia de disacaridasa cumplen criterios para SII18.
Se estima que el 65% de la población mundial tiene una capacidad reducida para digerir la lactosa después de la infancia19. La mayor prevalencia se encuentra en el sureste de Asia y en Sudáfrica, y la menor en el litoral del Mediterráneo y en las latitudes del Norte. Es importante señalar que cuando la ingesta de lactosa se limita a 240 ml de leche, o su equivalente al día, los síntomas suelen ser leves y no es necesario el uso de lactosa exógena20.
Deficiencia de sucrasa-isomaltasa
De acuerdo con la literatura reciente, se ha identificado una deficiencia de sucrasa-isomaltasa en adultos con síntomas de SII-D. Esta condición se presenta con frecuencia en pacientes pediátricos. Se han encontrado cuatro mutaciones genéticas en el dominio de la sucrasa o de la isomaltasa en la mayoría de los cambios comunes de nucleótidos en niños con deficiencia congénita de sucrasa-isomaltasa21. En adultos, se han identificado las mismas cuatro mutaciones en el gen de la sucrasa o de la isomaltasa. La deficiencia de sucrasa-maltasa es más prevalente en los pacientes con SII en comparación con los controles, tal como se demostró en un estudio en el cual el 2.1% de los sujetos con SII presentaron la deficiencia frente al 1.2% de los controles22, y en otro estudio similar en el cual se demostró la deficiencia en el 4% de los pacientes con SII y en el 2.8% de los controles23.
Disfunción de la barrera
Varios estudios han documentado un aumento de la permeabilidad intestinal y colónica en los pacientes con SII24, que predispone a la activación inmunitaria o a la inflamación25. Una revisión sistemática identificó que la permeabilidad intestinal se encuentra aumentada, en comparación con los controles, en los pacientes con SII-D (9/13 estudios) o SII-PI (post-infeccioso) (4/4 estudios), pero esta permeabilidad solo estuvo presente en una minoría de pacientes con SII-E (2/7 estudios). Además, existe una asociación positiva entre la pérdida de la función de barrera y síntomas como dolor abdominal y cambios en el hábito defecatorio26. La permeabilidad aumentada se presenta particularmente en pacientes con diarrea por ácidos biliares, en quienes la permeabilidad se incrementa en el SII-D27]. Este aumento de la permeabilidad puede estar asociado a la activación inmunitaria o de mastocitos28].
Activación inmunitaria
Diversas líneas de investigación han demostrado una activación inmunitaria de la mucosa en el SII. Existe un número elevado de células B y de células plasmáticas en proximidad a los mastocitos en la mucosa intestinal, relacionados con la activación inmunitaria adaptativa en el SII, sin aumento de la inmunoglobulina G sérica (IgG), en contraste con el aumento de la IgG luminal29. Además, hay evidencia de un aumento de la liberación de mediadores nociceptivos por células inmunitarias y el epitelio intestinal, lo que lleva al incremento de la excitabilidad de los receptores pronociceptivos de la neuronas provocando hipersensibilidad visceral. Se ha estudiado la relación de la inflamación mucosa o la activación inmunitaria con los síntomas o subgrupos de SII. La evidencia de la activación inmunitaria en el recto y el colon izquierdo está documentada, aunque no existe asociación de los síntomas o del trastorno intestinal predominante30. En un estudio31 con biopsias de mucosa de colon en pacientes con SII (30 mujeres con SII-E, y 31 mujeres y 13 hombres con SII-D) no hubo diferencia en las expresiones de 181 genes en el colon ascendente y 199 genes en el rectosigmoides. La mayoría fueron genes de sobreexpresión en el SII-D, con funciones en la activación de genes de inflamación, TRPV1 (hipersensibilidad visceral) y neurotransmisores/receptores (específicamente purinérgicos, ácido gamma-aminobutírico y cannabinoides). A pesar de las diferentes expresiones de los genes en la mucosa del colon ascendente y el rectosigmoides en el SII-E y el SII-D, la diversidad de sobreexpresión de genes involucrados en funciones inmunitarias, receptores, transmisores, canales iónicos y transportadores en ambos subgrupos de SII similares. En cambio, existe una reducción de la expresión de genes de inhibidor de peptidasa PI15 y PI16, los cuales inhiben las proteasas en el SII-D, lo que sugiere una vulnerabilidad de la mucosa a los efectos de las proteasas (por ejemplo, pancreáticas o bacterianas) en el SII-D31. La activación inmunitaria diferencial en la mucosa del colon ascendente en biopsias de 11 pacientes con diarrea por ácidos biliares y 33 controles con SII-D mostraron mayor activación en la diarrea por ácidos biliares32. Se han encontrado diferencias mínimas en la expresión de las biopsias de mucosa de íleon de pacientes con SII-E o SII-D y sujetos sanos33. Sin embargo, estudios extensos utilizando mucosa de yeyuno de pacientes con SII han encontrado respuestas inmunitarias aberrantes, aumento de la inmunidad humoral, alteración molecular y funcional de la barrera epitelial intestinal, alteración del metabolismo de los ácidos biliares, proximidad de las células plasmáticas a los nervios, activación de mastocitos y proteasas, y señalización de neuropéptidos y disbiosis que pueden relacionarse con el origen de los síntomas en los pacientes con SII. Esta información sugiere el papel del intestino delgado en la fisiopatología del SII, en particular del SII-D34.
Producción de químicos durante la activación inmunitaria
Diversos factores intestinales, incluyendo los ácidos biliares, los ácidos grasos de cadena corta, las proteínas de barrera de la mucosa, la histamina, las proteasas, la triptasa, los productos de las células enteroendocrinas y el ARN mensajero de la mucosa, se encuentran alterados y pueden desempeñar un papel importante en el SII, especialmente en el SII-D. Los mediadores inmunitarios, en particular aquellos relacionados con los mastocitos, pueden activar directamente o sensibilizar los nervios transmisores del dolor, produciendo un aumento de la señalización y dolor abdominal. Los mecanismos de la hipersensibilidad visceral incluyen a la histamina, la serotonina, las proteasas y el factor de crecimiento neuronal, los cuales se encuentran presentes en la mucosa de los pacientes con SII. La histamina actúa en los receptores H1 que sensibilizan a los canales de TRPV1, TRPA1 y TRPV435. La histamina y la serotonina aumentan la expresión y la translocación de la membrana en los nociceptores, ocasionando hipersensibilidad neuronal36. La tripsina y otras proteasas en la mucosa causan endocitosis, mediando la hiperexcitabilidad aferente a través de la sensibilización de los canales TRP. El aumento del factor de crecimiento neuronal de los mastocitos incrementa la densidad de las fibras nerviosas, mientras que el aumento del factor neurotrófico derivado del cerebro produce un incremento en el desarrollo de los nervios37.
Microbioma y SII
Por otro lado, el microbioma, que comprende la comunidad microbiana intestinal saludable, es diverso, estable, resistente y resiliente. La disbiosis intestinal sucede cuando la composición y la función del microbioma intestinal se alteran, potencialmente por patobiontes, comensales o disminución de la diversidad. Las infecciones, la inflamación, la dieta, los xenobióticos, la genética, la alteración del ciclo circadiano, la dieta materna, el embarazo y el daño físico pueden contribuir a la disbiosis38. Una revisión sistemática y metaanálisis38 no encontró una microbiota característica asociada al SII, y tampoco una diferencia entre los microbiomas en el SII-D y el SII-E; sin embargo la calidad de la evidencia fue baja. En otros estudios38 longitudinales del microbioma, en 30 individuos con SII-E, SII-D y controles sanos, se observó una sobreposición significativa, pero con diferencias en la diversidad. Cabe señalar que seis pacientes con SII-D y seis pacientes con SII-E presentaron síntomas con distintos tipos de microbiota. La significancia del diagnóstico y el tratamiento en la caracterización del microbioma en el SII sigue siendo poco clara39.
Relevancia clínica de la clasificación (Fig. 1)
El conocimiento acerca de los fenotipos, los endofenotipos y los subtipos del SII es de suma importancia para individualizar el tratamiento en cada paciente, y nos permite tener mejores estrategias en el seguimiento de cada caso. En lo que respecta a las medidas iniciales, la guías actuales para el tratamiento del SII priorizan la educación, la relación médico-paciente, las recomendaciones dietéticas y los tratamientos sintomáticos, como laxantes osmóticos para el estreñimiento, loperamida para la diarrea y antiespasmódicos para el control del dolor, e incluso la psicoterapia. Algunas guías priorizan el tratamiento farmacológico y la terapia conductual cerebro-intestino para el SII de moderado a grave. Por ello, de acuerdo con los mecanismos y biomarcadores del SII previamente mencionados, utilizar un abordaje basado en algoritmos según los síntomas puede resultar poco útil para optimizar el tratamiento del SII40.
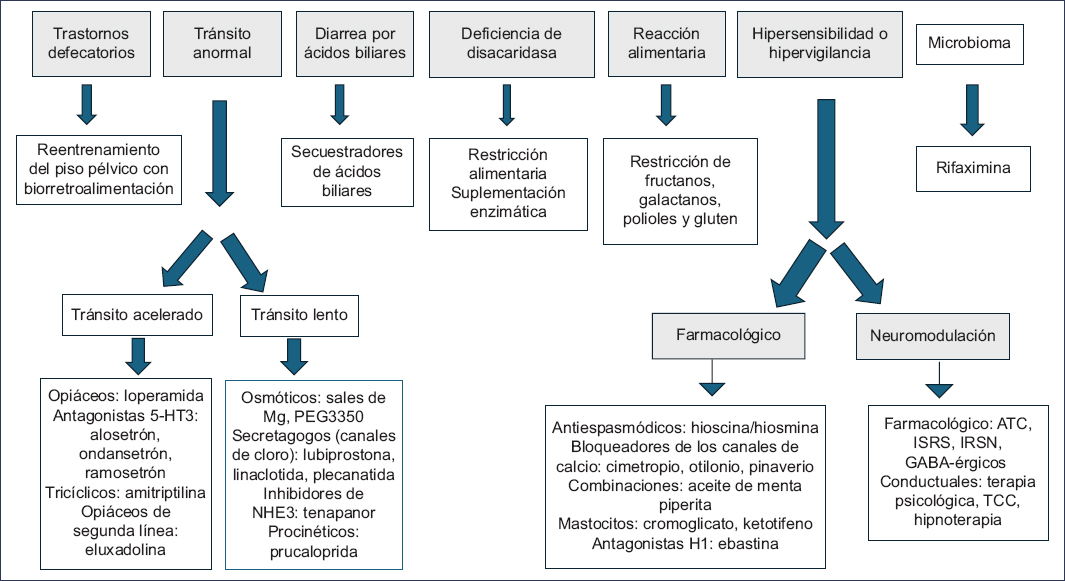
Figura 1. Tratamiento del síndrome de intestino irritable según los endofenotipos. ATC: antidepresivos tricíclicos; GABA: ácido gamma-aminobutírico; IRSN: inhibidores de la recaptura de serotonina y noradrenalina; ISRS: inhibidores selectivos de la recaptura de serotonina; TCC: terapia cognitivo-conductual.
Las medidas dietéticas incluyen un aumento de la ingesta de fibra soluble, dieta baja en FODMAP (Fermentable Oligosaccharides, Disaccharides, Monosaccharides, and Polyols) y dieta libre de gluten. La fibra soluble, en especial el Psyllium, es más efectiva que la no soluble para pacientes con SII-E. Existen varios ensayos clínicos pequeños y revisiones sistemáticas y metaanálisis sobre la dieta baja en FODMAP; sin embargo, su eficacia, comparada con placebo o con otras dietas, como la dieta NICE y la dieta de la Asociación Británica de Dietética (British Dietetic Association), es similar41. Por otro lado, diversos estudios muestran que una dieta baja en FODMAP puede reducir el transporte de endotoxinas a través de la mucosa en modelos animales, disminuyendo la contracción muscular abdominal en respuesta a la exposición de la mucosa rectal de heces de pacientes con SII con niveles elevados de endotoxinas42. Además, los pacientes con SII tienen grandes cantidades de histamina urinaria, lo que sugiere que puede ser un biomarcador para la respuesta a una dieta baja en FODMAP o que tal vez puedan beneficiarse de los antagonistas H1R43.
En cuanto a la dieta libre de gluten, no se ha demostrado beneficio en pacientes con SII. Dos ensayos clínicos controlados, en los que se incluyeron 111 participantes, mostraron una reducción en el riesgo de aparición de síntomas cuando la dieta con gluten se reinició posterior a una dieta con restricción de gluten44.
Un abordaje novedoso para corregir la deficiencia de sucrasa-isomaltasa, similar a la suplementación de lactasa para la hipolactasia, es la administración de sacrosidasa, una enzima disponible comercialmente que puede disminuir los síntomas en el SII45.
En la práctica clínica, los agentes farmacológicos se prescriben con frecuencia en los pacientes con SII para el tratamiento del dolor. Los antiespasmódicos son efectivos, pero la evidencia de su eficacia es limitada. Los bloqueadores de los canales de calcio y el aceite de menta piperita son los agentes más efectivos, pero su disponibilidad es limitada. En un estudio se encontró que la ebastina, un bloqueador de los receptores H1, disminuye el dolor en los pacientes con SII46. Por otro lado, los neuromoduladores de acción central, como los antidepresivos, se utilizan y recomiendan ampliamente en el tratamiento del SII; sin embargo, la evidencia de su eficacia es débil debido a que existen pocos ensayos clínicos, así como también sesgos y una sobreestimación de su efectividad. El PEG 3350, que es un tratamiento de primera línea para el estreñimiento crónico, no ha sido evaluado formalmente en el SII-E. Sí existen varios estudios que han evaluado los secretagogos de cloro (lubiprostona, linaclotida, plecanatida) y el inhibidor del intercambio de sodio-hidrógeno tipo 3 (tenapanor), los cuales han mostrado eficacia y han sido aprobados por la Food and Drug Administration (FDA) para el tratamiento del SII-E en pacientes menores de 65 años sin enfermedad cardiovascular47.
La loperamida es el tratamiento de primera línea para el SII-D, pero no se han realizado ensayos clínicos de gran tamaño en pacientes con SII. La eluxadolina actúa sobre los receptores opioides y disminuye la diarrea, pero está contraindicada en pacientes con colecistectomía. Los antagonistas de los receptores de 5-HT3 son efectivos en el SII-D48. En cuanto a los antibióticos no absorbibles, la rifaximina es más efectiva para los síntomas globales y la distensión abdominal, y está aprobada por la FDA para el tratamiento del SII-D49. En lo que respecta al trasplante de microbiota fecal, las revisiones sistemáticas y metaanálisis muestran resultados contrastantes acerca de su eficacia en el SII50.
La amplia disponibilidad de pruebas clínicas no invasivas para determinar los mecanismos implicados en los síntomas de SII ofrece una oportunidad en el avance del tratamiento individualizado, orientado por la fisiopatología y los biomarcadores clínicos identificados.
Síndrome de intestino irritable en poblaciones especiales
Niños
Los trastornos del eje intestino-cerebro son frecuentes en los niños y adolescentes, ocasionando síntomas gastrointestinales que ameritan el uso de los servicios de salud, distrés psicosocial y ausentismo escolar51. La fisiopatología exacta de los trastornos del eje intestino-cerebro no es clara y su origen es multifactorial, presentando factores internos y externos. Los factores internos incluyen susceptibilidad genética, antecedentes de infección, inflamación intestinal, anormalidades del microbioma, trastornos psicológicos, experiencias adversas durante la infancia y respuesta al dolor52. Además, los factores estresantes externos, los factores culturales y la respuesta de los cuidadores a los síntomas pueden ser importantes como factores de riesgo. Por ejemplo, un niño puede desarrollar SII-E posterior a una infección entérica, la cual causa inflamación y modifica la mucosa intestinal. La interpretación psicológica de los síntomas, como el dolor abdominal, como una amenaza al bienestar, especialmente en el contexto de experiencias adversas durante la infancia, puede exacerbar la intensidad de los síntomas. Si un cuidador hace preguntas excesivas, busca atención médica con frecuencia y produce angustia en el niño, este puede experimentar síntomas persistentes y significativos, así como mal aprovechamiento y deficiencia en su desarrollo.
En cuanto a la epidemiología, la prevalencia global del SII en la población pediátrica es del 8.8%53, siendo más alta en Sudamérica (16.8%) y Asia (16.5%), mientras que en Europa es del 10.5%.
En lo que respecta a la calidad de vida, los niños con trastornos del eje intestino-cerebro tienen puntajes más bajos en comparación con niños sanos. Los trastornos del eje intestino-cerebro son la segunda causa más frecuente de ausentismo escolar, destacando su prevalencia y su impacto negativo en la calidad de vida y en la función54.
Para el diagnóstico de SII se dispone de pruebas mínimamente invasivas, como exámenes serológicos y en heces, pruebas de aliento y estudios radiográficos, y otras más invasivas como endoscopia, manometría y prueba de pH-impedancia. Se debe considerar un abordaje escalonado basado en los síntomas del paciente y la sospecha clínica, además de informar debidamente a los pacientes y sus cuidadores acerca de los exámenes que se solicitarán, ya que la mayor parte de ellos no presentarán ninguna alteración y no se obtendrá una conclusión diagnóstica. Por lo tanto, el diagnóstico de SII se basa en una anamnesis y una exploración física detalladas, y en la aplicación de los criterios diagnósticos de Roma IV. Las serologías para enfermedad celiaca con niveles totales de IgA y anticuerpos antitransglutaminasa tisular IgA son apropiadas si existe evidencia de retraso en el desarrollo, falla de crecimiento o pérdida de peso. También se pueden considerar cuando un niño padece dolor abdominal crónico y presenta cambios en su hábito defecatorio, particularmente diarrea crónica55.
El modelo biopsicosocial es una herramienta valiosa para conceptualizar y tratar el SII, integrando aspectos biológicos, sociales y psicológicos de la enfermedad, lo cual permite identificar de forma adecuada comorbilidad psicológica o psiquiátrica, y atenderla oportunamente56.
En cuanto al tratamiento, se recomiendan los cambios en el estilo de vida para evitar la polifarmacia y los efectos adversos de los medicamentos. La realización de actividades positivas y la disminución de las negativas pueden restaurar la funcionalidad y proteger frente a la discapacidad social, escolar y laboral. Los profesionales de la salud pueden asesorar a los pacientes para que realicen actividades, fomenten la inteligencia emocional y disminuyan el ausentismo escolar57. Con respecto a las modificaciones dietéticas, no se recomienda ninguna especificación, ya que la evidencia es limitada. Por otro lado, la terapia psicológica, como la terapia cognitivo-conductual y la hipnoterapia, es útil en muchos pacientes y cuenta con evidencia suficiente de su eficacia en el tratamiento del SII en población pediátrica58.
En cuanto al uso de probióticos, existen varios estudios con resultados discrepantes con Lactobacillus rhamnosus GG y Lactobacillus reuteri en el SII, por lo que no se recomienda su uso sistemático en los niños59. Y respecto al tratamiento farmacológico, se pueden utilizar medicamentos con acción periférica, central y en el sistema nervioso entérico. En los Estados Unidos de América se utilizan antiespasmódicos, como la hiosmina y la diciclomina. Estos fármacos relajan el músculo liso intestinal mediante mecanismos anticolinérgicos para reducir el dolor. A pesar de no contar con evidencia suficiente para el tratamiento del SII en población pediátrica, se utilizan por periodos cortos de tiempo en caso de dolor abdominal. Uno de sus efectos adversos es el estreñimiento, por lo que puede limitarse su uso en caso de estar presente60. Otras opciones de tratamiento son los neuromoduladores, los cuales son fármacos con efectos en el sistema nervioso, central y periférico, cuya función principal es el reducir la intensidad del dolor y los síntomas gastrointestinales. Los antidepresivos tricíclicos mejoran los síntomas gastrointestinales refractarios, pero producen prolongación del segmento QT, por lo que están contraindicados en caso de cardiopatías. El escitalopram es el inhibidor de la recaptura de serotonina más estudiado y resulta de utilidad para tratar la depresión, la ansiedad y el trastorno obsesivo-compulsivo. Los inhibidores de la recaptura de serotonina y de noradrenalina, como la venlafaxina y la duloxetina, mejoran el dolor y los trastornos del estado de ánimo, y están aprobados por la FDA para tratar el trastorno de ansiedad generalizada. La evidencia para su uso en pediatría es limitado, pero sus efectos son similares a los de la amitriptilina, por lo que se utilizan en otros trastornos crónicos en los que el dolor es el síntoma predominante61.
Los laxantes y los antidiarreicos se utilizan con mucha frecuencia en pacientes pediátricos, pero se deben administrar con precaución porque pueden exacerbar la diarrea y el estreñimiento, respectivamente. Los laxantes más utilizados en pediatría son el polietilenglicol, la lactulosa, la leche de magnesia, el bisacodilo y la senna. En cuanto a los antidiarreicos, la loperamida y el subsalicilato de bismuto se usan con frecuencia. Por otro lado, los antidiarreicos están contraindicados en casos de infecciones entéricas o enfermedad inflamatoria intestinal. Dentro de las nuevas opciones terapéuticas se incluyen la linaclotida (agonista de la guanilato ciclasa-C) y los secuestradores de ácidos biliares (colestiramina y colestipol). Para el tratamiento del SII-D, las nuevas opciones incluyen proteína/inmunoglobulina aislada de suero bovino y glutamina62.
Adultos mayores
En los adultos mayores, el impacto del SII no ha sido estudiado ampliamente y sus manifestaciones no son claras. Los estudios epidemiológicos sugieren que la prevalencia del SII disminuye con la edad, posiblemente por cambios en la percepción del dolor, pero continúa siendo una afección gastrointestinal común en los ancianos. Por desgracia, se han realizado pocos estudios que evalúen los factores de riesgo, el diagnóstico y el tratamiento del SII en los adultos mayores. Existen razones para pensar que tiene un comportamiento diferente en los adultos mayores y que su tratamiento debe basarse en la edad del paciente. Según un estudio danés, la prevalencia del SII es del 6-18% dependiendo de la definición y de los criterios clínicos utilizados; después de 5 años de seguimiento, el 50-79% de los sujetos que cumplían criterios para SII ya no los tenían63. En un estudio realizado en el condado de Olmsted, en Minnesota (EE.UU.), se encontró una prevalencia de SII del 10.9% utilizando los criterios de Manning64.
Uno de cada cinco pacientes con SII tienen antecedente de gastroenteritis aguda, y de acuerdo con los estudios en adultos mayores, el riesgo es menor en comparación con pacientes más jóvenes. Neal et al.68 estudiaron a 544 pacientes del Notthingham Health Authority en el Reino Unido, registrando los síntomas gastrointestinales durante 6 meses antes y después de la confirmación de una gastroenteritis bacteriana. El diagnóstico de SII se realizó por dos médicos expertos y hubo un acuerdo interobservador del 72%. Uno de cada cuatro sujetos tuvieron síntomas intestinales persistentes y uno de cada 14 desarrollaron SII. Con respecto al pronóstico, el SII en los adultos mayores tiene un curso favorable, tal como se confirmó en un estudio38 con 5 años de seguimiento en el que el 50-79% de los pacientes dejaron de presentar síntomas durante el seguimiento.
Los factores psicológicos pueden influenciar la evolución natural del SII en pacientes jóvenes, pero esto no se ha demostrado en adultos mayores65. En un estudio de seguimiento durante 16 meses en pacientes jóvenes se reportó que la presencia de eventos estresantes durante la vida fue un predictor para la intensidad de los síntomas, y que los pacientes que mejoraron no contaban con estos antecedentes66. Un estudio de 1,119 adultos mayores encontró que el SII y la dispepsia fueron más frecuentes en aquellos con disminución de sus funciones físicas y cognitivas, y además el SII se asoció con una disminución de la funcionalidad en los 5 años de seguimiento67.
El diagnóstico diferencial de los síntomas colónicos en los adultos mayores es similar al de los pacientes jóvenes, pero la presencia de enfermedades orgánicas en este grupo de edad es más frecuente. La realización de colonoscopia es importante para descartar cáncer colorrectal y otros padecimientos68.
En cuanto al tratamiento del SII en los adultos mayores, sigue siendo empírico y sintomático, con enfoque en las modificaciones dietéticas y la realización de actividad física como tratamiento de primera línea. La ingesta de fibra soluble debe aumentarse gradualmente para minimizar la intolerancia. Además, la deshidratación es frecuente en los adultos mayores y debe orientarse al paciente para mantener una adecuada hidratación69.
El SII en los adultos mayores es poco diagnosticado e investigado, a pesar de su gran impacto económico y en la calidad de vida.
Embarazadas
El SII tiene una alta prevalencia en las embarazadas debido a su frecuencia en las mujeres en edad reproductiva. El embarazo puede exacerbar los síntomas del SII, con un aumento del 11-38% de estreñimiento, en especial en el tercer trimestre, pero un 34% reportan aumento en la frecuencia de las evacuaciones70.
El embarazo exacerba el trastorno obsesivo-compulsivo y aumenta los comportamientos hipocondriacos y la fobia a la enfermedad. El estrés aumenta en el tercer trimestre de embarazo, lo que posiblemente predispone a la exacerbación de los síntomas de SII71.
En lo que respecta a la función intestinal durante el embarazo, los estudios en humanos y en modelos animales muestran cambios en la función motora gastrointestinal durante el embarazo, con un tránsito orocecal prolongado en los humanos y retardado en los ratones72. Las hormonas en el embarazo, particularmente los estrógenos y la progesterona, tienen impacto en la función gastrointestinal, empeorando potencialmente los síntomas de SII. Estas hormonas pueden retardar el tránsito intestinal y el vaciamiento gástrico, aunque también tienen un efecto analgésico que puede disminuir el dolor en el SII.
En cuanto al tratamiento, durante el embarazo se recomiendan las modificaciones dietéticas, en particular la suplementación con fibra. El Psyllium pueden aumentar la consistencia de las heces, disminuir el tiempo de tránsito intestinal y mejorar el estreñimiento. Sin embargo, la efectividad de la suplementación con fibra varía dependiendo del tipo de fibra y de los síntomas específicos del SII73. El tratamiento del SII durante el embarazo prioriza las modificaciones dietéticas y la intervención psicológica por encima de los fármacos, ya que los que están indicados se clasifican dentro de las categorías B, C o D de la FDA. Los laxantes osmóticos, incluyendo la lactulosa y el polietilenglicol, son efectivos para el estreñimiento en el embarazo; la lactulosa mejora la frecuencia y la consistencia de las evacuaciones después de 2 semanas. Otros laxantes, como el docusato, el bisacodilo, la senna y la fenoltaleína, también son seguros; la dantrona puede ser teratogénica. Los laxantes con solución salina hipertónica deben utilizarse con precaución debido a la posibilidad de alteraciones electrolíticas74. En el caso del SII-D, los opiáceos de acción periférica son el tratamiento inicial para pacientes no embarazadas. La loperamida por lo general es segura durante el embarazo, mientras que el difenoxilato con atropina se debe evitar por sus efectos teratogénicos75. Otros grupos de fármacos, como los antiespasmódicos, los agentes anticolinérgicos y los bloqueadores de los canales de calcio, se prescriben con frecuencia en el SII, en particular en caso de dolor abdominal. Sin embargo, su uso durante el embarazo es limitado por los potenciales riesgos, en especial con los agentes anticolinérgicos76. En lo que respecta a los neuromoduladores, los antidepresivos tricíclicos son efectivos en el tratamiento de los síntomas de SII en mujeres no embarazadas; la amitriptilina, la trimipramina y la desipramina muestran beneficios para varios síntomas, y existen estudios de seguridad sobre el uso de antidepresivos en el embarazo que no muestran un aumento en el riesgo de malformaciones fetales ni efectos adversos a largo plazo. Sin embargo, se deben considerar los potenciales riesgos y solo prescribirlos si se presentan síntomas graves de SII durante el embarazo77. Otros agentes, como la simeticona, el carbón activado y las enzimas pancreáticas, pueden reducir la distensión abdominal en el SII, pero aún no se ha estudiado su uso durante el embarazo78. Por otro lado, las terapias psicológicas, incluyendo la terapia cognitivo-conductual, la hipnosis y el entrenamiento para la relajación muscular, han mostrado resultados prometedores en el tratamiento de los síntomas y la mejoría de la calidad de vida. Estas terapias son particularmente benéficas en embarazadas con síntomas graves. La medicina alternativa y complementara para el SII, como la medicina herbolaria tradicional china, muestra resultados variables en mujeres no embarazadas, y se desconocen su seguridad y eficacia en embarazadas, por lo que no es recomendable su uso79.
Conclusión
La identificación adecuada de los subtipos de SII y sus fenotipos es de suma importancia, ya que permite realizar un abordaje y un tratamiento individualizado que impacta de manera favorable en el alivio de los síntomas y la mejora de la calidad de vida de los pacientes. Entre las distintas opciones de tratamiento se encuentran las modificaciones dietéticas y el tratamiento farmacológico, en el cual se incluyen laxantes, antidiarreicos, antiespasmódicos y neuromoduladores. Las opciones no farmacológicas, como las terapias psicológicas, son efectivas en ciertos pacientes, sobre todo en aquellos que cuentan con el antecedente de eventos adversos a temprana edad. También es fundamental el abordaje del SII de acuerdo con el grupo de edad, ya que el tratamiento y la respuesta a este pueden variar según las características de cada grupo especial.
Financiamiento
El autor declara no haber recibido financiamiento para este estudio.
Conflicto de intereses
El autor declara no tener conflicto de intereses.
Consideraciones éticas
Protección de personas y animales. El autor declara que para esta investigación no se han realizado experimentos en seres humanos ni en animales.
Confidencialidad, consentimiento informado y aprobación ética. El estudio no involucra datos personales de pacientes ni requiere aprobación ética. No se aplican las guías SAGER.
Declaración sobre el uso de inteligencia artificial. El autor declara que no utilizó ningún tipo de inteligencia artificial generativa para la redacción de este manuscrito.
