Definición
El síndrome de intestino irritable (SII) es un trastorno de la interacción intestino-cerebro caracterizado por dolor abdominal asociado a cambios en el patrón intestinal, y puede adoptar cuatro subtipos de acuerdo con el predominio de dicho hábito: SII con predominio de diarrea (SII-D), estreñimiento (SII-E), mixto (SII-M) o inespecífico (SII-I)1. El SII-D se define, de acuerdo con los criterios clínicos diagnósticos de Roma IV, por la presencia de dolor abdominal recurrente, que ocurre al menos una vez por semana, durante los últimos 3 meses, con inicio de síntomas 6 meses antes del diagnóstico, asociado a predominio de diarrea, definida como disminución en consistencia (heces tipo Bristol 6 o 7), o aumento en la frecuencia de las heces, durante más del 25% del tiempo total, y heces duras (Bristol 1 o 2) en menos del 25% del tiempo1
–3. Se diferencia de la diarrea funcional (DiF) en que el síntoma pivote en el SII-D es el dolor1.Epidemiología
La incidencia de SII se estima entre el 1.3 y el 1.5%1, y la prevalencia varía de acuerdo con la región geográfica y los criterios diagnósticos utilizados. La prevalencia global de acuerdo con el grupo de Roma varía entre el 7 y el 21%4,5. Usando criterios de Roma I es del 8.8%, según Roma II del 7.8-9.4%, según Roma III del 9.1-11.5% y según Roma IV del 5-10%5,6. La prevalencia en México varía de acuerdo con el área geográfica y se estima en el 4-35%7
–11. Existe menos información relativa a la prevalencia por subtipos, pero se estima que el SII-D, el SII-E y el SII-M afectan en una proporción similar, aunque en algunos reportes el SII-D es más frecuente, alcanzando hasta el 40% de los casos12,13, y en otros como en México representa un porcentaje menor (9%)10,14.Fisiopatología del síndrome de intestino irritable
El SII-D es una enfermedad multifactorial que involucra múltiples mecanismos fisiopatológicos que pueden coexistir, e incluyen factores genéticos, alteraciones en la barrera intestinal, permeabilidad e inflamación de bajo grado, alergias e intolerancias alimentarias, diarrea asociada a ácidos biliares (DAB), disbiosis, disfunción neuroinmune, señalización anormal, hipersensibilidad visceral y desregulación del eje cerebro-intestino (ECI) con alteraciones en el procesamiento central o periférico del dolor2,15–20. Un factor de riesgo encontrado con frecuencia en el SII-D es el antecedente de gastroenteritis infecciosa o intoxicación alimentaria previas, las cuales aumentan cuatro veces el riesgo de desarrollar SII postinfeccioso (SII-Pi), con una prevalencia acumulada del 7.3-10.1%, y que alcanza el 15-30% durante epidemias, o el 5-10% en diarrea del viajero21,22. Otro factor recientemente implicado es la infección por coronavirus 2 del síndrome respiratorio agudo grave (SARS-CoV-2), particularmente en pacientes con manifestaciones gastrointestinales (GI) durante la infección aguda23.
Evaluación y diagnóstico diferencial
El diagnóstico diferencial principal en SII-D incluye otras causas de dolor abdominal asociado a diarrea crónica, que pueden incluir cambios en anatomía o fisiología posquirúrgica (colecistectomía, bypass gastroyeyunal, resecciones intestinales o colectomías), efecto secundario de medicamentos (laxantes, secretagogos, enterocinéticos, antibióticos, antisecretores gástricos, inhibidores de angiotensina, levotiroxina, orlistat, acarbosa, inhibidores selectivos de recaptura de serotonina [ISRS] y colchicina), causas infecciosas (Giardia, Clostridioides difficile), inflamatorias (enfermedad inflamatoria intestinal [EII], colitis microscópicas), malabsortivas (sobrecrecimiento bacteriano de intestino delgado [SIBO], enfermedad celíaca y otras enteropatías, insuficiencia pancreática exocrina)24. Existen diversos abordajes diagnósticos, incluyendo guías nacionales e internacionales (Fig. 1)13,24–27. La mayoría de las guías sugieren descartar causas infecciosas, particularmente Giardia, mediante estudios coprológicos, como un panel GI fecal por reacción en cadena de la polimerasa, además de EII en forma inicial mediante biomarcadores fecales no invasivos como calprotectina cuantitativa, síndromes de absorción intestinal deficiente mediante biometría hemática, marcadores de absorción intestinal (niveles séricos de vitamina B12, ácido fólico, cinética de hierro), y una serología para enfermedad celíaca (anticuerpos antitransglutaminasa tisular IgA y niveles séricos IgA, anticuerpos antiendomisio o anticuerpos antigliadina desaminada IgG), y cuando existen síntomas de alarma, estudios endoscópicos con biopsias intestinales para descartar enterocolitis microscópicas y eosinofílica. En casos especiales, cuando existe el antecedente reciente de gastroenteritis infecciosa y persistencia sintomática, puede considerarse la realización de pruebas de aliento para confirmar o excluir SIBO, o la determinación de anticuerpos anti-CdtB (toxina citoletal de Campylobacter), y antivinculina, en sospecha de SII-D Pi, aunque la S es baja, inclusive con las nuevas correcciones de epítopes, y finalmente descartar DAB, pero debido a la poca disponibilidad de los ensayos comerciales, esta se puede confirmar en forma indirecta mediante una prueba terapéutica con resinas secuestradoras de ácidos biliares13,24–26.
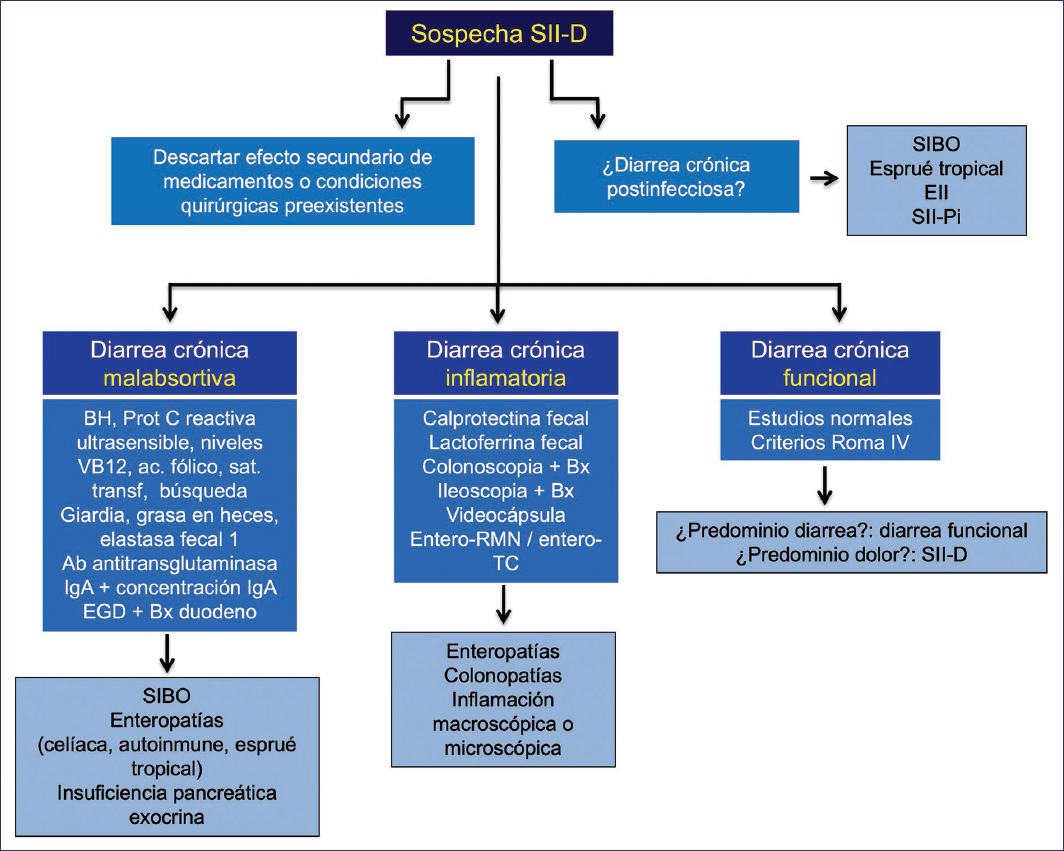
Figura 1. Abordaje diagnóstico del SII-D/diarrea funcional. SIBO: sobrecrecimiento bacteriano de intestino delgado; EII: enfermedad inflamatoria intestinal; SII-D: síndrome de intestino irritable con diarrea; SII-Pi: síndrome de intestino irritable postinfeccioso; BH: biometría hemática; PCR: proteína C reactiva ultrasensible; VB12: vitamina B12; sat. transf: saturación de transferrina; EGD: esofagogastroduodenoscopia; Bx: biopsia; RM: resonancia magnética; TC: tomografía contrastada.
Tratamiento
El mejor entendimiento de los mecanismos fisiopatológicos del SII-D y DiF han permitido evaluar opciones terapéuticas dirigidas a cada uno de ellos (Tabla 1), e incluyen terapias dirigidas a intolerancia o síntomas relacionados con alimentos (dietas de restricción), terapias dirigidas a alteraciones motoras (antiespasmódicos), terapias dirigidas a disminuir inflamación de bajo grado o permeabilidad intestinal (mesalazina, esteroides, ebastina, larazotida), terapias dirigidas a SIBO o disbiosis (rifaximina, probióticos, prebióticos y trasplante de microbiota fecal), fármacos dirigidos a corregir homeostasis de líquidos (loperamida, eluxadolina, alosetrón, ramosetrón, ondansetrón y lidamidina), malabsorción de ácidos biliares (resinas de intercambio iónico: colestiramina, colestipol y colesevelam) y neuromoduladores15,18,28–30.
Tabla 1. Tratamiento del síndrome de intestino irritable con diarrea
| Mecanismo fisiopatológico | Opciones terapéuticas | Evidencia médica |
|---|---|---|
| Intolerancia dieta/alimentos | Dieta baja en FODMAP Dieta sin gluten | Mejoría sintomática, individualizable |
| Alteraciones motoras | Antiespasmódicos | Mejoría dolor corto/mediano plazo, NNT 3-11 |
| Inflamación bajo grado | Mesalazina, prednisolona ketotifeno, cromoglicato, ebastina | Puntajes inflamación, no mejoría sintomática |
| Disbiosis | Antibióticos acción local (rifaximina) Probióticos | Mejoría global, número y consistencia, distensión, S1B0, S11-no E Mejoría síntomas globales |
| Alteraciones permeabilidad intestinal | Glutamina, larazotida | Estudio piloto, no estudios controlados |
| Alteraciones homeostasis líquidos | Antagonistas 5-HT3 (alosetrón, ondansetrón) ibodutant) | Mejoría número y consistencia (A, O), efecto antinociceptivo (A), NNT 4-8 (A) Antinociceptivo (mujeres) |
| Alteraciones homeostasis ácidos biliares | Colestiramina, colesevelam, colestipol Eluxadolina Liraglutida |
Evidencia indirecta (diarrea ácidos biliares) Mejoría sintomática (en VB sana) No inferior a colesevelam |
| Disfunción eje cerebro-intestino | Neuromoduladores tricíclicos (amitriptilina, imipramina, nortriptilina) ISRS, IRNS | Mejoría global, puntaje dolor, NNT 3 Mejoría global como grupo |
5-HT3: hidroxitriptamina; A: alosetrón; FODMAP: fructanos, oligosacáridos, monosacáridos y polioles; IRNS: inhibidores de la recaptura de noradrenalina y serotonina; ISRS: inhibidores selectivos de la recaptura de serotonina; NNT: número necesario que tratar; O: ondansetrón; SIBO: sobrecrecimiento bacteriano de intestino delgado; SII-no E: síndrome de intestino irritable sin estreñimiento; VB: vesícula biliar.
Terapias dirigidas a intolerancia o síntomas relacionados a alimentos
Aunque la mayoría de los pacientes asocian la dieta como desencadenante sintomático, solo el 11-27% tienen intolerancia documentada a una dieta en particular. La dieta puede ocasionar síntomas mediante efectos osmóticos, químicos, mecánicos o modificando la microbiota. No existe hasta la fecha un protocolo nutricional estándar que sea útil para todos los pacientes con SII-D, por lo que la dieta se debe individualizar de acuerdo con los antecedentes, tolerancia y respuesta particular de cada paciente. Algunas medidas generales como moderar porciones, reducir la fibra insoluble, evitar el sorbitol y los endulzantes artificiales, la cafeína, la fructosa y el alcohol pueden ser de utilidad en algunos pacientes. La dieta baja en FODMAP (acrónimo para fructanos, oligosacáridos, disacáridos, monosacáridos y polioles fermentables) permite identificar alimentos comúnmente desencadenantes de dolor y distensión, y puede ser individualizada tras un periodo de identificación inicial. Hay diferentes protocolos para llevarla a largo plazo. La dieta libre de gluten no ha mostrado mejorar los síntomas de SII-D a menos que el paciente tenga enfermedad celíaca, aunque es importante considerar que puede haber sobreposición entre ambas entidades28,31,32.
Terapias dirigidas a alteraciones motoras y manejo sintomático
Los antiespasmódicos son fármacos que relajan el músculo liso intestinal mediante efecto calcioantagonista, bloqueando canales de sodio, o por efecto antimuscarínico, anticolinérgico, o incluso sobre más de un receptor, incluyendo 5-HT (5-hidroxitriptamina) y neurocinina. Se dividen en varias categorías: calcioantagonistas (bromuro de pinaverio, citrato de alverina, fenoverina, rociverina, pirenzepina y aceite de menta); aminas terciarias (trimebutina y mebeverina), cuaternarias derivadas de amonio (bromuro de pinaverio, bromuro de otilonio y bromuro de prifinio), derivados de escopolamina (butilhioscina, levsina, hiosciamina, dicicloverina y cimetropio) y derivados de fenol (fluoroglucinol)33. Los antiespasmódicos representan la primera línea de tratamiento para control sintomático de dolor abdominal a corto y mediano plazo. Varios metaanálisis han demostrado su superioridad sobre placebo para mejoría como grupo tanto de los síntomas globales (número necesario que tratar [NNT] de 5), como puntajes de dolor abdominal (NNT 7, rango 3-11). Aunque la evidencia es menor, los NNT individuales por antiespasmódico son similares: bromuro de otilonio y mebeverina NNT 5; bromuro de pinaverio, alverina y diciclomina NNT 4; bromuro de hioscina y cimetropio NNT 311,27,33–37. Varios de ellos tienen una preparación comercial combinada con simeticona/dimeticona (un antiespumante que disminuye la tensión superficial de burbujas mucogaseosas), y/o galactosidasa (una enzima que hidroliza olisacáridos no absorbibles), y parecen tener un efecto adicional sobre distensión. Algunos antiespasmódicos, al tener actividad anticolinérgica, pueden asociarse a estreñimiento y mejorar el hábito intestinal en los pacientes con SII-D, sin embargo no hay estudios que evalúen este efecto11,34,36.
Terapias dirigidas a disminuir la inflamación de bajo grado
Varias líneas de investigación han evaluado fármacos dirigidos a distintos objetivos asociados a disminuir la inflamación intestinal de bajo grado, incluyendo esteroides de acción local (p. ej., budesonida), corticosteroides sistémicos (prednisolona), mesalazina, estabilizadores de mastocitos (ketotifeno y cromoglicato disódico) y antagonistas de histamina (ebastina). La evidencia actual con prednisolona y cromoglicato disódico, y previa con mesalazina, indica que aunque mejoran los puntajes de inflamación (disminución del número de células inflamatorias), esta mejoría no se traduce en mejoría clínica significativa28,30,38; sin embargo una revisión y metaanálisis reciente con ocho estudios (n = 820) concluyó que la mesalazina puede ser modestamente eficaz en mejoría de síntomas globales, particularmente para SII-D, pero no en otros subgrupos, ni en SII-Pi (riesgo relativo [RR]: 0.88; intervalo de confianza del 95% [IC 95%]: 0.79-0.99), aunque la calidad de la evidencia es baja39. Evidencia preliminar ha reportado que tanto el ketotifeno como la ebastina incrementan los umbrales de sensación rectal a distensión con barostato en un subgrupo de pacientes con SII, pero tampoco han mostrado utilidad real en SII-D29,30. Se ha propuesto que fármacos dirigidos a restaurar la permeabilidad intestinal podrían mejorar los síntomas en SII-D, y aunque desde el punto de vista hipotético y experimental la glutamina y el acetato de larazotida pueden tener efectos sobre la expresión de claudina 1, una proteína asociada a permeabilidad, y regulación de uniones estrechas respectivamente, no hay estudios controlados en SII ni SII-D30.
Terapias dirigidas a corregir la disbiosis
Múltiples estudios han demostrado un papel central de la microbiota en la fisiopatología del SII, y alteraciones de esta, como ocurre en SIBO o en disbiosis, se puede asociar a desarrollo de síntomas. Varias opciones dirigidas a tratar SIBO (antibióticos de acción local como rifaximina) y disbiosis (probióticos, prebióticos y trasplante de microbiota fecal) se han probado en el SII40,41. La rifaximina es un antibiótico sintético de amplio espectro no absorbible que inhibe la síntesis de ácido ribonucleico (ARN) bacteriano, con cinco polimorfismos (α,β,γ,δ y ε), aprobada para su uso en SIBO y SII sin estreñimiento (SII-noE)42 con base en los resultados de los estudios TARGET 1 y 2, en los cuales se reportó que la rifaximina alfa a dosis de 550 mg tres veces al día por 14 días se asoció a mejoría significativa sintomática global (desenlace primario), y de dolor, distensión, y consistencia (sueltas o acuosas) de las heces (desenlaces secundarios)43. La definición de respondedor en el subanálisis de diarrea fue reducción ≥ 50% en el número basal de días con evacuaciones Bristol 6 o 7 durante 2 o más de las primeras 4 semanas de tratamiento43. Estudios subsecuentes derivados de la misma cohorte como el TARGET-3 demostraron mejoría con tratamientos repetidos, y predicción de mejoría cuando se confirma SIBO por prueba de aliento, y un subanálisis de este estudio demostró además mejoría de dolor abdominal en el 56.8%44,45. Se han propuesto varios mecanismos de acción detrás de los efectos de rifaximina, incluyendo eliminación de bacterias patógenas, modificación de microbiota (tipo y diversidad), alteración en expresión de factores de virulencia, y efectos indirectos derivados de esta corrección de disbiosis como efecto antiinflamatorio o de protección sobre la barrera intestinal42.
Los probióticos son microorganismos que administrados en cantidades adecuadas proveen un efecto benéfico al huésped, y pueden tener efectos directos sobre diversidad microbiana, o indirectos, por medio de estimulación del sistema inmunitario y mejoría de la función mucosa. Varias revisiones sistemáticas y metaanálisis han mostrado un efecto limitado, pero significativamente superior, de los probióticos como grupo sobre placebo para mejoría de síntomas globales, con disminución significativa en persistencia de síntomas (RR: 0.79; IC 95%: 0.68-0.91) y NNT de 7, con una evidencia mayor para combinaciones sobre cepas únicas46. Los subanálisis han reportado mejoría en puntajes de dolor y flatulencia, y una tendencia de mejoría en distensión, pero la heterogeneidad de los estudios limita los hallazgos, y la evidencia de beneficio por subtipo de hábito intestinal es escasa40,41.
El trasplante de microbiota fecal es una terapia emergente para condiciones asociadas a disbiosis grave como infección recurrente por C. difficile. En SII se ha evaluado en varios ensayos clínicos, con resultados conflictivos. Un metaanálisis reciente evaluó ocho estudios clínicos controlados (ECC) y no demostró beneficio significativo en síntomas 3 meses después de la maniobra terapéutica47.
Terapias dirigidas a alteración en homeostasis de líquidos y ácidos biliares
Cuatro grupos de medicamentos pueden mejorar los síntomas de SII-D asociados a distintos mecanismos involucrados en alteraciones de la peristalsis, secreción y motilidad intestinal aumentada: los agonistas opioides (loperamida y eluxadolina), los antagonistas 5-HT3 (alosetrón, ramosetrón y ondansetrón), los agonistas alfa-2 (lidamidina) y las resinas secuestradoras de ácidos biliares (colestiramina, colestipol, colesevelam y ácido obeticólico).
Los agonistas de receptores opioides tipo μ (loperamida y difenoxilato) aumentan la absorción de líquidos intestinales y disminuyen la velocidad de tránsito GI y colónico, y se utilizan con frecuencia como antidiarreicos. La loperamida se ha evaluado en estudios clínicos usando criterios previos de SII-D, y ha mostrado ser superior a placebo para mejoría sintomática global, en consistencia de las heces, y en dolor abdominal, aunque la evidencia es de baja calidad48. La eluxadolina es un medicamento con doble efecto sobre receptores opioides: es agonista de receptores tipo μ y κ, y agonista del receptor σ. El estudio pivote con 2,427 pacientes comparó dos dosis, 75 y 100 mg, con placebo, y el desenlace primario fue la proporción de pacientes con disminución en el puntaje compuesto de dolor y mejoría en consistencia fecal el mismo día al menos en el 50% de los días en dos periodos de tiempo, a 12 y 26 semanas, y la proporción de pacientes que cumplieron el desenlace en ambos puntos fue significativamente superior con ambas dosis de eluxadolina que con placebo49. El NNT para cumplir estos objetivos es 850. Varios estudios han demostrado su efectividad para diferentes desenlaces o subgrupos: es efectiva en pacientes que han tenido control inadecuado o adecuado con loperamida51, tiene efectividad similar a antiespasmódicos de acuerdo con un metaanálisis de red reciente, pero con una tasa mayor de efectos secundarios52, y la respuesta inicial se asocia a beneficios sostenidos hasta por 6 meses53. Un efecto secundario reportado es mayor riesgo de pancreatitis y espasmo de Oddi en pacientes con colecistectomía, por lo que se recomienda su uso en sujetos con vesícula biliar sana54,55.
La 5-HT es un importante modulador de la secreción y nocicepción intestinal. Varios antagonistas de los receptores 5-HT3 se han evaluado en SII-D (alosetrón, ramosetrón y ondansetrón). El alosetrón, el más estudiado, tiene una ganancia terapéutica del 20-30% sobre placebo, y un NNT de 4-8 (a dosis 0.5 mg dos veces al día), para disminuir el número de evacuaciones, además de un efecto antinociceptivo, y mejoría en calidad de vida, pero con un perfil de seguridad asociado a estreñimiento grave e incluso colitis isquémica, por lo que en EE.UU. se encuentra bajo un programa especial de prescripción56,57. El ramosetrón fue evaluado en cuatro ECC, y un metaanálisis reciente con 1,623 pacientes reportó mejoría global, dolor/molestia abdominal, mejoría en hábito intestinal y consistencia fecal58. Ninguno de estos dos medicamentos se encuentra disponible en nuestro país. El ondansetrón, disponible en México, se evaluó en un ECC a dosis ajustada entre 4-8 mg/d en un trabajo interrumpido por la pandemia de 2020 y que incluía inicialmente a 400 pacientes, de los cuales se aleatorizaron 80 y se compararon con placebo, reportando una ganancia terapéutica del 12% a favor de ondansetrón. Al juntar los datos de este estudio con los ensayos previos, el NNT es de 5 para mejoría en consistencia de las heces, y de 9 para lograr la variable compuesta de la Food And Drug Administration (FDA) caracterizada por mejoría global, de dolor y consistencia fecal, sin diferencia en la variable de dolor abdominal59
–61.La lidamidina es un agonista alfa-2 que, al igual que la loperamida, se ha evaluado en dos ECC usando criterios diagnósticos previos. El primero comparó en forma cruzada lidamidina a 2 dosis (8 o 16 mg) contra placebo, y no hubo mejoría ni en síntomas globales ni en consistencia de las heces62. Un segundo estudio, realizado en México en 1997, comparó en forma cruzada cuatro grupos de SII por criterios de Manning, los cuales recibieron lidamidina o placebo con o sin psicoterapia. Se reportó mejoría significativa con lidamidina (89.5 vs. 65.8%; p = 0.02) sin diferencia significativa tras adicionar psicoterapia63.
Varios agentes secuestradores de ácidos biliares (colestiramina, colestipol, colesevelam y ácido obeticólico) han demostrado reducción del tránsito colónico y mejoría de la consistencia fecal en DAB, pero la evidencia en SII-D y DF es indirecta, dado que la mayoría de las veces se utiliza como prueba terapéutica13,24,25,64. Recientemente la liraglutida, un análogo del péptido similar al glucagón tipo 1 (GLP-1), utilizado en obesidad y diabetes mellitus, mostró un efecto similar al colesevelam en un estudio de no inferioridad en DAB, pero no hay estudios en SII-D65. Dentro de las terapias emergentes dirigidas a secreción intestinal, el idobutant, un antagonista selectivo de la neurocinina 2, una familia de neuropéptidos mediadores de motilidad y nocicepción, mostró beneficio dependiente de la dosis en mujeres con SII-D66.
Terapias dirigidas a neuromodulación del eje cerebro-intestino
Uno de los mecanismos fisiopatológicos clave en cualquier forma de SII es la disfunción neuroinmune del eje cerebro-intestino. Los neuromoduladores se han convertido en una de las mejores herramientas en todos los subtipos del SII, al mediar tanto a nivel central como periférico la señalización, percepción y procesamiento del dolor67
–69. En forma general, los neuromoduladores son útiles para control del dolor en cualquier subtipo de SII. En SII-D los antidepresivos tricíclicos (ATC) (imipramina, amitriptilina, desipramina y nortriptilina) son el grupo más evaluado y han demostrado ser significativamente superiores a placebo para mejoría global y en puntaje de dolor, con NNT entre 3 y 4.570. Un ECC reciente denominado ATLANTIS demostró que la amitriptilina es eficaz para control de dolor en cualquier subtipo de SII, y la evidencia reciente parece indicar que no empeora los síntomas de estreñimiento en SII-E71. Debido a sus efectos sobre receptores tanto muscarínicos como adrenérgicos y de histamina, reduce la frecuencia de diarrea pero se asocia a efectos secundarios como sequedad de boca, somnolencia y estreñimiento, por lo que se sugiere su uso a dosis ascendente, para obtener el beneficio máximo entre las semanas 6 y 868,69.Los ISRS (sertralina, paroxetina, citalopram y escitalopram) se recomiendan en SII para el manejo de los síntomas de ansiedad e hipervigilancia, ya que el efecto antinociceptivo es bajo, y pueden asociarse a disminución en consistencia fecal69.
Los inhibidores de recaptura de noradrenalina y serotonina (IRNS) (duloxetina, venlafaxina, desvenlafaxina y milnaciprán) son una alternativa para control de dolor en SII-D cuando los ATC no son bien tolerados. Un estudio abierto reportó que la duloxetina por 12 semanas mejoró los puntajes de dolor abdominal, urgencia evacuatoria y distensión abdominal72.
Los delta-ligandos (pregabalina y gabapentina) son neuromoduladores de acción periférica. La pregabalina se ha evaluado en tres ECC en SII, y ha demostrado mejorar los umbrales de sensación rectal en pacientes con hipersensibilidad, incrementar los umbrales de deseo defecatorio y mejorar los puntajes de dolor73
–75. Uno de los estudios reportó mejoría también en frecuencia de diarrea75. La evidencia con otros grupos de neuromoduladores en SII es escasa, existe evidencia anecdótica de reportes de casos con mirtazapina, un tetracíclico, en SII-D, y no hay evidencia con azapironas o con antipsicóticos atípicos11,67,69.Conclusiones
El SII-D representa entre el 9 y 40% de los casos de SII. Tiene fisiopatología multifactorial, que puede incluir predisposición genética, intolerancia alimentaria, disbiosis, inflamación de bajo grado, alteraciones en la barrera intestinal y permeabilidad, disfunción neuroinmune y alteración en el procesamiento central de sensaciones. Como parte de la evaluación de diarrea crónica se deben descartar causas medicamentosas, diarrea infecciosa, inflamatoria y malabsortiva mediante un escrutinio básico dirigido. Las opciones terapéuticas van dirigidas al mecanismo fisiopatológico y control sintomático, y pueden incluir restricciones dietéticas, antidiarreicos que actúan sobre receptores opioides (loperamida y eluxadolina), antibióticos locales como rifaximina, probióticos, antagonistas 5-HT3 (alosetrón, ramosetrón y ondansetrón), resinas secuestradoras de ácidos biliares (colestiramina) y neuromoduladores, particularmente ATC. La evidencia con mesalazina y lidamidina es menor.
Financiamiento
Los autores declaran no haber recibido financiamiento para este estudio.
Conflicto de intereses
O. Gómez-Escudero: conferencista para Adium, Alfasigma, Carnot, Chinoin, Faes Farma. R. Carmona-Sánchez: participación en protocolo de investigación con Laboratorios Senosiain.
Consideraciones éticas
Protección de personas y animales. Los autores declaran que para esta investigación no se han realizado experimentos en seres humanos ni en animales.
Confidencialidad, consentimiento informado y aprobación ética. El estudio no involucra datos personales de pacientes ni requiere aprobación ética. No se aplican las guías SAGER.
Declaración sobre el uso de inteligencia artificial. Los autores declaran que no utilizaron ningún tipo de inteligencia artificial generativa para la redacción de este manuscrito.