Introducción
La enfermedad por reflujo gastroesofágico (ERGE) es una de las enfermedades más frecuentes en todo el mundo. Se estima que la tasa de prevalencia ronda entre el 13% y el 20% de la población general, aunque existe una gran variabilidad regional1,2. La ERGE, definida desde el consenso de Montreal, es un padecimiento en el cual sintomáticamente se reconocen manifestaciones esofágicas (divididas a la vez en solo síntomas y con lesión de mucosa) y extraesofágicas (divididas a su vez en aquellas con y sin asociación establecida)2,3 (Fig. 1). Así mismo, estos síndromes muestran tres presentaciones fenotípicas: ERGE no erosiva (60-70% de los pacientes), ERGE erosiva (alrededor del 30%) y esófago de Barrett (6-8% de los casos)4.
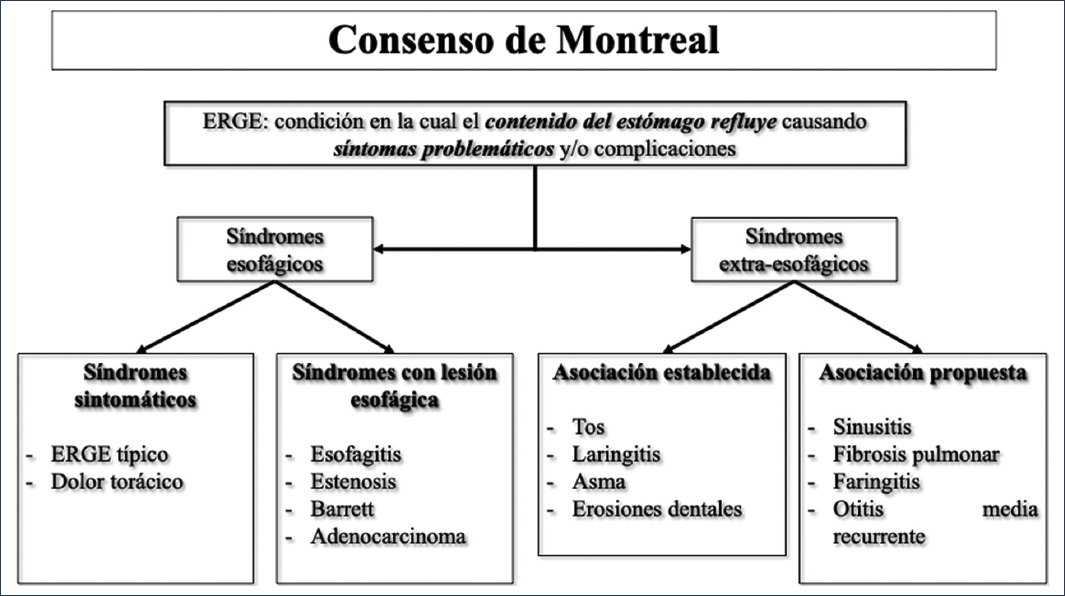
Figura 1. Clasificación de la enfermedad por reflujo gastroesofágico (ERGE) de acuerdo con el consenso de Montreal.
A pesar de las diferentes modalidades y combinaciones de manejo que existen en la actualidad, se ha reportado que hasta un 40% de los pacientes fallan al tratamiento médico, por múltiples causas (Table 1). Actualmente se considera que la ERGE refractaria está definida por la presencia de evidencia objetiva de ERGE (esofagitis erosiva o exposición anormal al ácido, o número de episodios de reflujo elevado en la monitorización ambulatoria del pH esofágico) bajo un tratamiento farmacológico óptimo2.
Tabla 1. Causas de síntomas persistentes de enfermedad por reflujo gastroesofágico
| Falta de adherencia al tratamiento |
| Inadecuada prescripción o administración |
| Polimorfismos genéticos (metabolismo de IBP) |
| Mala calidad de los fármacos |
| Hipersensibilidad esofágica |
| Hipervigilancia, ansiedad, somatización |
| Pirosis funcional |
| Otras enfermedades esofágicas:
Esofagitis eosinofílica Esofagitis por píldoras (AINE, potasio, bisfosfonatos) Esofagitis infecciosas |
| Trastornos motores del esófago:
Acalasia Espasmo esofágico distal Esófago hipercontráctil |
| Trastornos gastroduodenales:
Eructos supragástricos excesivos Síndrome de rumiación |
| Otras:
Síndrome de Zollinger-Ellison Gastroparesia |
|
AINE: antiinflamatorios no esteroideos; IBP: inhibidores de la bomba de protones. |
En esta revisión se describirán los fenotipos de reflujo encontrados en la práctica clínica, así como la definición de ERGE verdaderamente refractaria.
Enfermedad por reflujo gastroesofágico no erosiva
Definición
Dentro de los fenotipos de la ERGE, la enfermedad por reflujo no erosiva (ERNE) es la más frecuente en la práctica clínica, pues se presenta hasta en el 70% de los pacientes evaluados por endoscopía2,5. Los pacientes pueden tener manifestaciones clínicas típicas y atípicas de reflujo, pero la endoscopía no muestra anormalidades en el esófago ni en las biopsias obtenidas del mismo. La figura 2 muestra una imagen endoscópica típica de un paciente con ERNE.
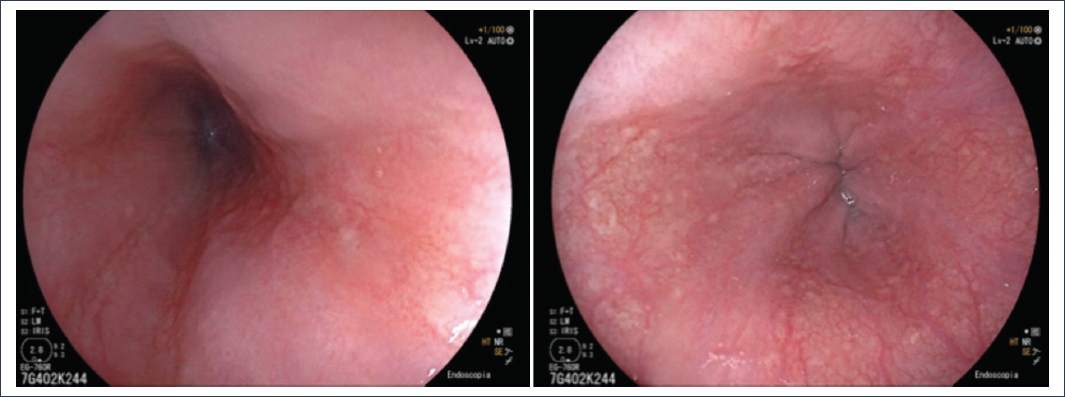
Figura 2. Imágenes representativas de una endoscopía sin hallazgos significativos.
En este grupo de pacientes es indispensable realizar un diagnóstico de precisión por medio de una pH-metría ambulatoria, ya que, como se puede apreciar en la figura 3, solo el 50% tendrán una «verdadera ERNE», mientras que el resto padecerán un trastorno funcional esofágico (pirosis funcional e hipersensibilidad al reflujo).
En muchas ocasiones, el diagnóstico de esta condición es retador porque la presentación clínica y la fisiopatología son muy heterogéneas y suelen ser indistinguibles sin pruebas que permitan hacer un diagnóstico de precisión6. Atendiendo a este problema, el consenso de Lyon 2.04 (Fig. 4) ha provisto de una serie de criterios y herramientas que ayudan a discriminar entre los pacientes que se encuentran en este grupo; así, la evidencia concluyente para el diagnóstico de ERGE está dada por un tiempo de exposición al ácido (TEA) mayor del 6%. Cuando el TEA se encuentra entre el 4% y el 6% se precisan criterios complementarios para tener una mejor certidumbre en el diagnóstico, los cuales incluyen el número de episodios de reflujo, la histología y las métricas de impedancia basal, entre otros.
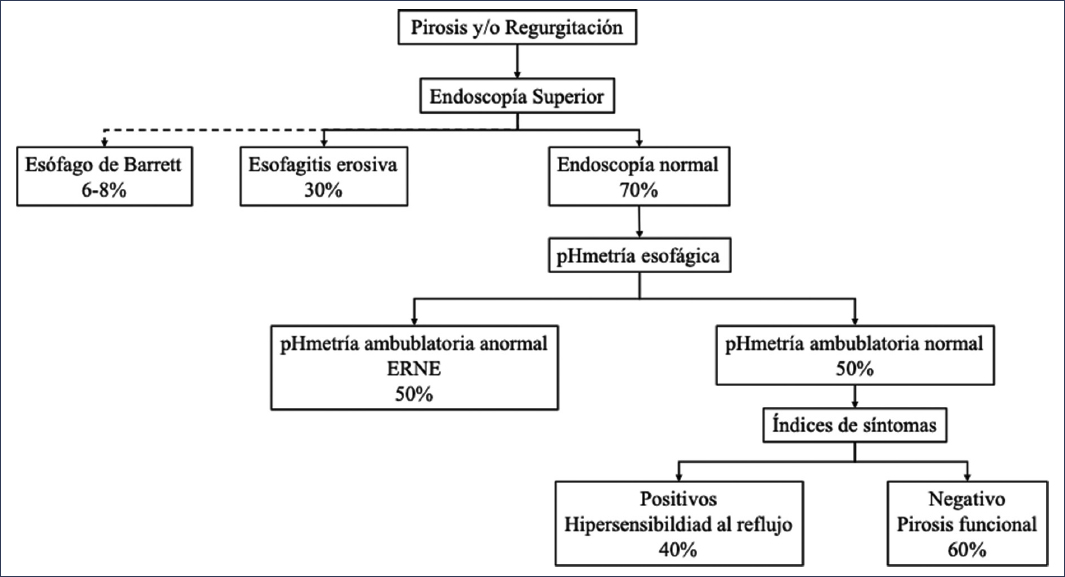
Figura 3. Fenotipos de reflujo. ERNE: enfermedad por reflujo gastroesofágico no erosiva (adaptado y traducido de Yamasaki y Fass5).
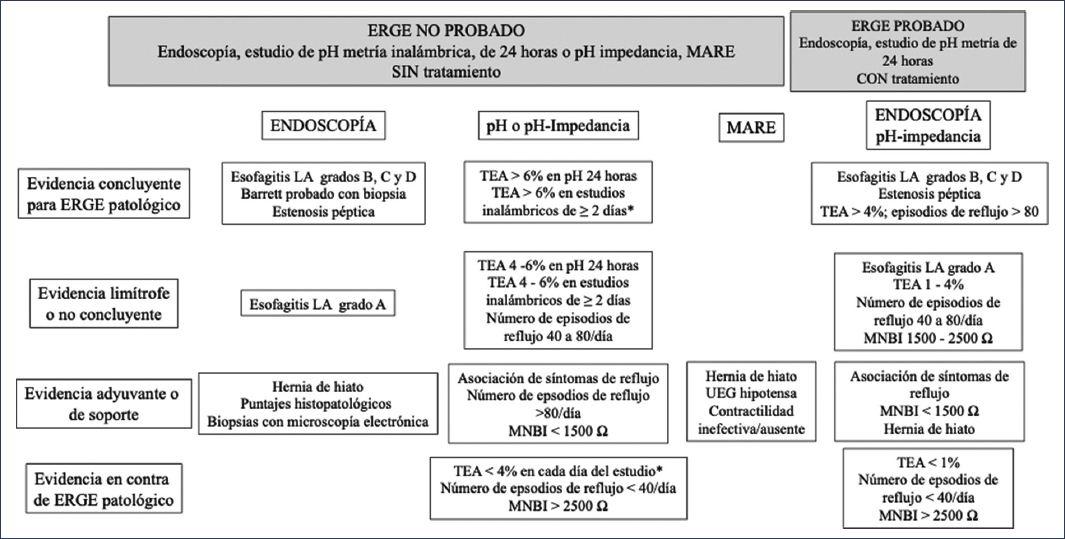
Figura 4. Consenso de Lyon 2.0 para el diagnóstico de enfermedad por reflujo gastroesofágico (ERGE)4,11. LA: Los Ángeles; MARE: manometría esofágica de alta resolución; MNBI: impedancia basal nocturna media; TEA: tiempo de exposición al ácido; UEG: unión esofagogástrica. *El valor del monitoreo ambulatorio debe cumplirse en todo el periodo evaluado.
Factores de riesgo y relevancia clínica
Como ya se ha mencionado, la ERNE es el fenotipo más frecuente de la ERGE y su complejidad radica en la presencia clínicamente indistinta de verdaderas ERNE contra otros diagnósticos diferenciales, como pueden ser hipersensibilidad al reflujo y pirosis funcional.
Existe evidencia de que, aunque no específicamente para este subgrupo, la presencia de ciertos factores incrementa la probabilidad de reflujo; estos se enlistan en la tabla 2, en la cual se incluyen las características que pueden explicar la alta prevalencia de esta condición. Dadas las similitudes en cuanto a factores de riesgo y presentación clínica, en este grupo es fundamental realizar un diagnóstico de precisión, pues las implicaciones para el manejo y el mantenimiento de las diferentes afecciones incluidas en este espectro de pacientes son significativas.
Tabla 2. Factores de riesgo para la enfermedad por reflujo gastroesofágico
| Factor de riesgo | RM |
|---|---|
| Edad ≥ 50 años | 1.32 (1.12-1.54) |
| Tabaquismo | 1.26 (1.04-1.52) |
| Uso de AINE | 1.44 (1.10-1.88) |
| Obesidad | 1.73 (1.146-2.06) |
| Índice de cintura/cadera elevado | 1.94 (1.12-5.23) |
| Consumo de alcohol | 1.51 (1.13-1.99) |
| Exfumador | 1.43 (1.13-1.90) |
|
* Tomado de Eusebi, et al.38. † Tomado de Sadafi, et al.39. AINE: antiinflamatorios no esteroideos; RM: razón de momios (IC 95%). |
|
Enfermedad por reflujo gastroesofágico erosiva
Definición, factores de riesgo y relevancia clínica
La ERGE erosiva es el segundo fenotipo más frecuente en esta patología. De acuerdo con los estudios descriptivos, se estima que entre el 10% y el 30% de los pacientes tendrán erosiones durante la evaluación endoscópica2,7. Así, la realización de una endoscopía superior es indispensable no solo para la identificación de las erosiones, sino también para cuantificar la gravedad y de este modo guiar el tratamiento apropiado de acuerdo con el riesgo que este hallazgo represente para el paciente8.
Aunque existen numerosas escalas para tratar de estandarizar los hallazgos endoscópicos en la ERGE, la Clasificación de Los Ángeles, publicada en 1996 y validada posteriormente, es la que en la actualidad ofrece la mejor estandarización y la correlación con los desenlaces clínicos9,10. En la figura 5 se muestran imágenes ilustrativas, así como la descripción de la clasificación de Los Ángeles. Es importante señalar que la esofagitis de grado A de Los Ángeles, dada su alta variabilidad interobservador, no se considera una evidencia concluyente de reflujo y por tanto no se encuentra incluida dentro de este grupo de pacientes11. En cuanto al resto de los grupos de la clasificación de Los Ángeles (esofagitis B, C y D), sí son considerados evidencia concluyente de ERGE2,11 (Fig. 6) y requieren tratamiento médico por 8 semanas2. Es notable mencionar que la gravedad de la esofagitis se correlaciona con la tasa de curación endoscópica, tal como ilustra un estudio multicéntrico japonés en el que los pacientes con esofagitis de grado C y D tuvieron unas tasas de curación de alrededor del 70% y el 60% respectivamente12, pudiendo recurrir hasta en el 75% bajo tratamiento estándar13,14.
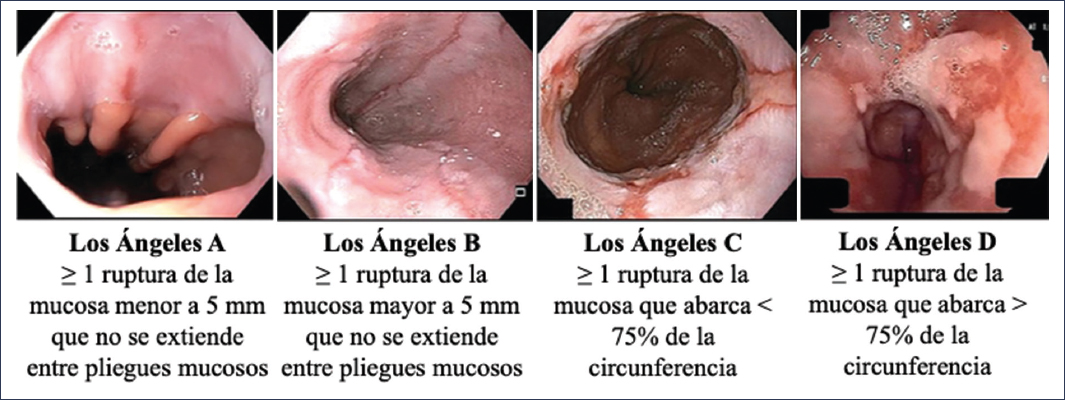
Figura 5. Representación gráfica de la clasificación de Los Ángeles (tomado y traducido de Lundell et al.10 y Spechler et al.40)<.
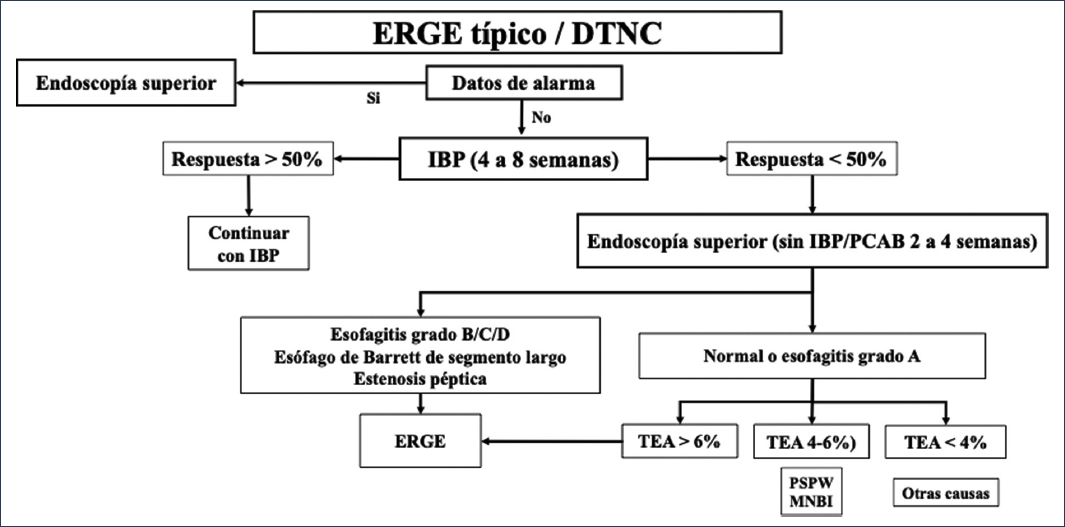
Figura 6. Clasificación de los pacientes basada en estudios diagnósticos en la enfermedad por reflujo gastroesofágico (ERGE). DTNC: dolor torácico no cardiaco; IBP: inhibidor de la bomba de protones; MNBI: impedancia basal nocturna media; PCAB: bloqueador de ácido competitivo con potasio; PSPW: onda peristáltica posdeglución; TEA: tiempo de exposición al ácido (modificado de Valdovinos-Díaz et al.2).
Esófago de Barrett
Definición, factores de riesgo y relevancia clínica
El esófago de Barrett es una lesión premaligna para la presencia de adenocarcinoma de esófago caracterizada por el reemplazo del epitelio escamoso por una metaplasia intestinal con epitelio columnar, alternado con células caliciformes15,16. Se considera una de las complicaciones de la ERGE crónica y constituye una respuesta biológica a la lesión persistente de la mucosa del esófago.
Se estima que aproximadamente un 6% a 8% de los pacientes con ERGE presentan esófago de Barrett2, siendo más frecuente en los varones caucásicos en la sexta década de la vida17. No obstante, algunos estudios sugieren que la incidencia del esófago de Barrett no es diferente en población hispana18. Existen factores de riesgo para la presencia de esta enfermedad (Table 3), siendo la mayoría también factores de riesgo para adenocarcinoma esofágico19. Un metaanálisis que incluyó 49 estudios y 307,273 individuos demostró que en los pacientes con síntomas de reflujo y al menos un factor de riesgo propuesto la proporción de esófago de Barrett fue mayor que en aquellos sin síntomas de reflujo (12.2% vs. 0.8%). En este mismo metaanálisis, la presencia de ciertos factores de riesgo se asoció con mayor presencia de esófago de Barrett, como la historia familiar (23.4%), el sexo masculino (6.8%), la edad > 50 años (6.1%) y la obesidad central (1.9%)20.
Tabla 3. Factores de riesgo propuestos para la presencia de esófago de Barrett y adenocarcinoma esofágico
| Factor | Riesgo para esófago de Barrett | Riesgo para adenocarcinoma esofágico |
|---|---|---|
| Edad | Sí | Sí |
| Raza blanca | Sí | Sí |
| Sexo masculino | Sí | Sí |
| Pirosis crónica | Sí | Sí |
| Edad < 30 años al inicio de los síntomas | Sí | – |
| Hernia de hiato | Sí | Sí |
| Esofagitis erosiva | Sí | Sí |
| Obesidad con distribución intraabdominal | Sí | Sí |
| Síndrome metabólico | Sí | Sí |
| Uso de tabaco | Sí | Sí |
| Historia familiar de esófago de Barrett o adenocarcinoma esofágico | Sí | Sí |
| Apnea obstructiva del sueño | Sí | – |
| Bajo peso al nacer para la edad gestacional | Sí | No |
| Nacimiento pretérmino | No | Sí |
| Consumo de carne roja o carne procesada | Sí | Sí |
| Infección por el virus del papiloma humano | No | Sí |
|
Tomado de Spechler y Souza19. |
||
El riesgo de progresión del esófago de Barrett ha sido descrito en los estudios desde un 0.1% hasta un 3% por año21,22, y depende del grado de alteración estructural del epitelio, es decir, del grado de displasia19. En general, el riesgo de progresión hacia adenocarcinoma esofágico se estima en un 0.25% por año, pero para los pacientes con esófago de Barrett no displásico es aún menor, mientras que en aquellos con displasia de bajo grado se estima en aproximadamente un 0.54% por año y en los que tienen displasia de alto grado es de un 4% a un 8%23–25.
Ante este problema, resulta indispensable emplear sistemas de reporte de las características endoscópicas e histológicas de una forma estandarizada15. En la actualidad se recomienda el sistema de reporte de la clasificación de Praga, que incluye la descripción de la afectación circunferencial y la extensión máxima del epitelio columnar26, y ha demostrado tener un excelente coeficiente de confiabilidad para ambos parámetros (circunferencial 0.95 y extensión máxima 0.94)27. Adicionalmente, para realizar las biopsias se recomienda emplear el protocolo de Seattle, el cual indica tomarlas en cuatro cuadrantes en segmentos que abarquen de 1 a 2 cm circunferencialmente28,29. El uso de este protocolo ha demostrado incrementar hasta 13 veces la detección de displasia en el esófago de Barrett30 (Fig. 7). Por último, uno de los aspectos que puede contribuir sustancialmente a la correcta clasificación del grado de displasia es minimizar la variabilidad interobservador en la interpretación patológica de las biopsias31. Aunque no existe en la actualidad un consenso sobre la experiencia requerida del patólogo, las guías actuales recomiendan la interpretación por parte de dos patólogos con experiencia en interpretación de la patología esofágica, sobre todo en casos de displasia de alto grado27.
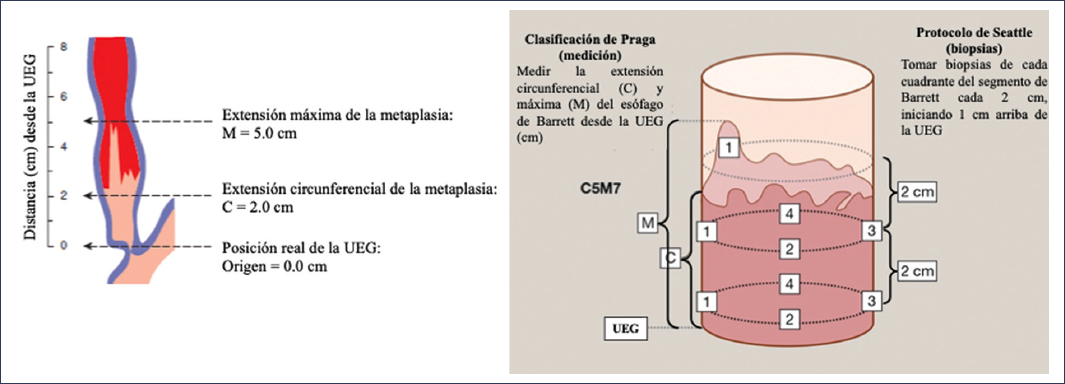
Figura 7. Sistema de reporte de la clasificación de Praga y protocolo de Seattle en el esófago de Barrett26,28–30. UEG: unión esofagogástrica.
Enfermedad por reflujo gastroesofágico refractaria
Definición, factores de riesgo y relevancia clínica
La persistencia de síntomas de ERGE ocurre en el 30% al 40% de los pacientes a pesar de un tratamiento médico apropiado32,33. Este frecuente escenario no necesariamente implica la presencia de ERGE refractaria, puesto que existen numerosas condiciones que pueden explicar la persistencia de los síntomas de ERGE a pesar de un tratamiento óptimo (Table 1). Así, resulta fundamental realizar una aproximación sistemática a este grupo de enfermos dependiendo de la presencia o no de evidencia objetiva de reflujo (esofagitis erosiva, esófago de Barrett, TEA anormal)2, reconociendo dos subgrupos de pacientes: aquellos sin evidencia objetiva de ERGE y aquellos con evidencia objetiva de ERGE. En el primer grupo debe considerarse realizar un abordaje diagnóstico apropiado, en el que implícitamente se recomienda estudiar a los pacientes antes que intentar un nuevo esquema de tratamiento (Figs. 1 y 8). En este grupo de pacientes, una gran proporción tendrán un diagnóstico no relacionado con la ERGE para explicar los síntomas, incluyendo los trastornos funcionales esofágicos34,35. Por su parte, en el grupo con evidencia objetiva de ERGE y persistencia de los síntomas, antes de considerar una evaluación se recomienda verificar la toma apegada y apropiada del tratamiento médico, y posteriormente considerar realizar la evaluación bajo tratamiento médico2 (Fig. 9). Es importante aclarar que, ante lo discutido previamente, la definición de verdadera ERGE refractaria requiere la evidencia objetiva de ERGE (esofagitis erosiva, esófago de Barrett o exposición anormal al ácido) a pesar del tratamiento médico óptimo por al menos 8 semanas32,36. Según esta definición, los criterios en la medición del pH y en la impedancia bajo tratamiento se consideran distintos de los incluidos en Lyon 2.011, con umbrales del 0.5% para el TEA y de 40 episodios de reflujo como criterios para predecir la respuesta al tratamiento escalado de la ERGE37.
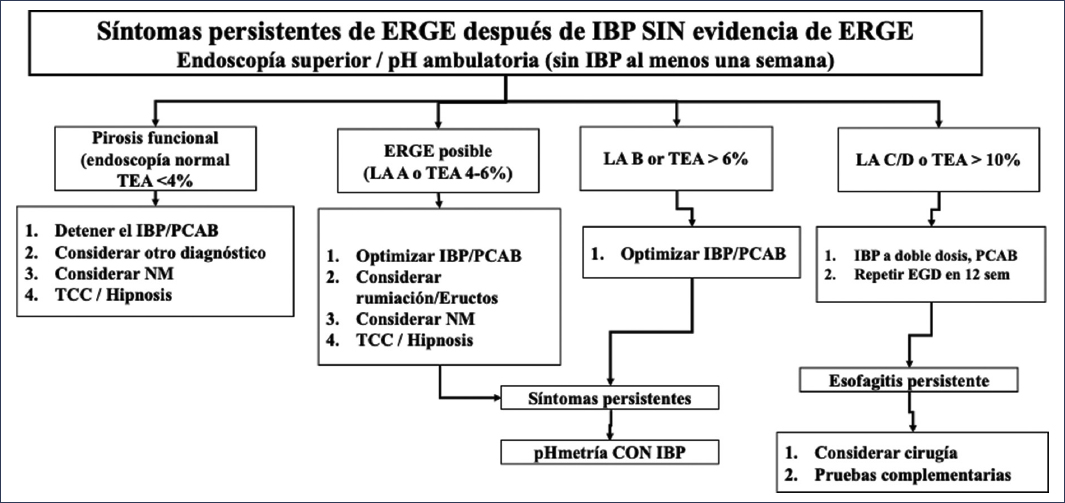
Figura 8. Algoritmo diagnóstico y terapéutico para pacientes con síntomas persistentes de reflujo sin evidencia objetiva previa de enfermedad por reflujo gastroesofágico (ERGE)2. EGD: endoscopía superior; IBP: inhibidor de la bomba de protones; LA: Los Ángeles; NM: neuromodulador; PCAB: bloqueador de ácido competitivo con potasio; TCC: terapia cognitivo-conductual; TEA: tiempo de exposición al ácido.
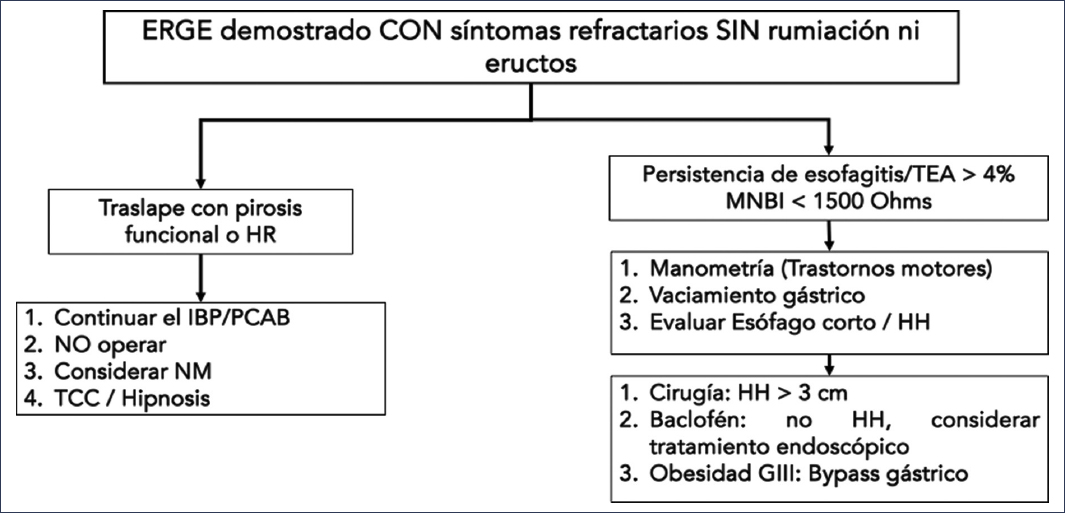
Figura 9. Algoritmo diagnóstico y terapéutico para pacientes con síntomas persistentes de reflujo sin evidencia objetiva previa de enfermedad por reflujo gastroesofágico (ERGE)2. HH: hernia hiatal; HR: hipersensibilidad al reflujo; IBP: inhibidor de la bomba de protones; MNBI: impedancia basal nocturna media; NM: neuromodulador; PCAB: bloqueador de ácido competitivo con potasio; TCC: terapia cognitivo-conductual; TEA: tiempo de exposición al ácido.
La correcta clasificación clínica (más que fenotípica) resulta crucial debido a las implicaciones que tiene para el manejo adecuado de los pacientes y la apropiada secuenciación de este. Los pacientes con verdadera ERGE refractaria pueden beneficiarse de alternativas más potentes o dosis elevadas de fármacos, y en casos seleccionados, intervención quirúrgica. En cambio, los pacientes con trastornos funcionales (hipersensibilidad esofágica o pirosis funcional, entre otros) se benefician más de los neuromoduladores o de intervenciones psicológicas2.
Conclusión
En el estudio y el tratamiento de la ERGE, el concepto fundamental es el diagnóstico apropiado dentro del espectro clínico de esta condición. Los pacientes pueden beneficiarse de distintas modalidades terapéuticas aplicadas de manera objetiva y a la medida de cada paciente.
Financiamiento
El autor declara no haber recibido financiamiento para este estudio.
Conflicto de intereses
El autor declara no tener conflicto de intereses.
Consideraciones éticas
Protección de personas y animales. El autor declara que para esta investigación no se han realizado experimentos en seres humanos ni en animales.
Confidencialidad, consentimiento informado y aprobación ética. El estudio no involucra datos personales de pacientes ni requiere aprobación ética. No se aplican las guías SAGER.
Declaración sobre el uso de inteligencia artificial. El autor declara que no utilizó ningún tipo de inteligencia artificial generativa para la redacción de este manuscrito.
